توجه:به دلیل این که نفتالین جز مواد آلی قرار دارد این گزارش کار به طور کلی برای خالص سازی مواد آلی استفاده میشود
مقدمه
درآزمایشگاه شیمی آلی 1 عمده مطالب دررابطه باروش های تخلیص(خالص سازی)می باشد که از جمله مهترین این روش ها می توان به تقطیر،استخراج ،تصعیدوتبلوراشاره نمود.
تقطیروروش های تقطیردرآزمایشگاه شیمی :
تقطیر،معمولترین روش است که برای تخلیص مایعات به کار می رود.دراین عمل مایع رابه کمک حرارت تبخیرمی کنندوبخارمربوطه رادرظرف جداگانه ای متراکم می کنندومحصول تقطیررابدست می آورند.جنانچه ناخالصی های موجود درمایع اولیه فرارنباشند،درباقی مانده تقطیربه جامی مانندوتقطیر ساده جسم راخالص می نمایید.درصورتی که ناخالصی هافرارباشند،تقطیر جزءبه جزء مورد احتیاج خواهد بود.
مهمترین روشهای تقطیر:
1. تقطیرساده
2. تقطیرجزء به جزء
3. تقطیربابخار آب
4. تقطیردرفشارکم
استخراج :
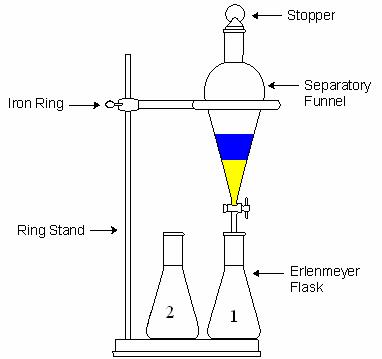
استخراج روشی برای جداسازی بوده که مستلزم انتقال جسمی ازیک فازبه فازدیگرمی باشد.دربرخی مواقع لازم است برای بازیابی یک جسم آلی ازمحلول آبی ازراههایی غیرازتقطیراستفاده شود.یکی ازاین راهها تماس دادن محلول آبی بایک حلال غیر قابل امتزاج می باشد.اگرحلال خاصیت جداسازی راداشته باشدبیشترموادآلی ازلایه آلی به حلال آلی(حلال غیرقابل امتزاج)انتقال پیدا می کند. ازجمله خواص از حلال که دراستخراج اهمیت دارد قابلیت انحلال کم وفرار بودن رامی توان نام برد.دراستخراج دومحلول وجودداردابتدانمونه درحلال یک قرارداردکه ازحلال دوم برای استخراجآن استفاده می شود درنتیجه دارای ثابت تعادل بوده که به آن ثابت توزیع گویند.
تصعید :
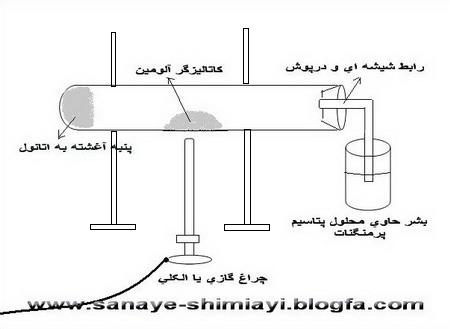
در این روش از اختلاف فشار بخار اجسام جامد استفاده می شود و این عمل از جهتی به تقطیر ساده شباهت دارد. نمونه ناخالص در درجه حرارتی پایین تر از نقطه ذوب آن گرم میشود و مستقیما از حالت جامد به صورت بخار در می آید و بعد بخار حاصل فورا در سطح سردی به حالت جامد متراکم میشود (متبلور میشود). این دو مرحله بدون مداخله حالت مایع صورت میگیرد.
تبلور :
تبلور یکی از بهترین روش های تخلیص اجسام جامد است روش عمومی تبلور عبارت است از حل
کردن جسم در حلال مناسب به کمک گرما و تهیه محلول سیر شده جسم ، صاف کردن سریع محلول
گرم ، سرد کردن تدریجی محلول صاف شده به منظور راسب کردن به شکل بلور ، صاف کردن و
شستن بلورها با حلال سرد و خشک نمودن آن ها،و بالاخره تعیین نقطه ذوب بلور.
تبلور معمولا در موقع تبدیل یک حالت فیزیکی به حالت فیزیکی دیگر صورت میگیرد.
این تبدیل به سه صورت انجام می گیرد:
1.تبلور در هنگام تبدیل حالت مایع به جامد
2.تبلور در هنگام تبدیل حالت بخار به جامد سوبلیماسیون
3. تبلور مواد جامد
آزمایش شماره (1)
تعیین دمای ذوب نفتالین
به منظورتعیین دمای ذوب نفتالین ،مقداری ازنفتالین جامد رابه لوله مویین منتقل نموده ولوله را که یک انتهای آن بسته می باشد رادرحمام آب گرم قرارمی دهیم .درادامه یک دماسنج رادرداخل حمام قرارداده وزمانی که اولین ذرات حباب مانند خارج شده ازلوله مویین را مشاهده کرده دمارابااستفاده از دماسنج می خوانیم.سپس حرارت دادن نفتالین را ادامه می دهیم تازمانی که شدت خروج حباب ها به حداکثربرسدوخروج آنها پیوسته باشد. دراین لحظه مجددا دماراازدماسنج خوانده ویاداشت می نماییم.
بقیه ازمایش ها به زودی قرار داده میشود