:::::::::::::::::::::::::::::::::::::::::::::::::::
ــــــــــــــ ــــــــــ ـــــــ ــــــــــ ـــــــــــــ ـــــــــ
ــــ::ـــــ العلــ ـــ ـــ ــم سلطـــ ــ ـان ـــــ::ــــــ
ــــــــــــــ ــــــــــ ـــــــ ــــــــــ ـــــــــــــ ـــــــــ
وبگاه علمی بی آر پرتو ، جهت اطلاع رسانی و ارائـه مطـــالب علمــی ایجاد شده و تقدیــمی است به همه دوستـــــداران علم ، به خصوص دانشجویـــان عزیز و اساتیـــد محترم و کارکنان دانشگاه حضرت امام خمینی (ره) بروجرد .
مهندسین پرتوپزشکی
:::::::::::::::::::::::::::::::::::::::::::::::::::
طبقه بندی موضوعی
-
مهندسی پرتو پزشکی
(۲) -
شیمی
(۹)-
گزارشکار آزمایشگاه
(۸)-
شیمی آلی
(۸)
-
-
-
فیزیک
(۱) -
آناتومی
(۱) -
فیزیولوژی
(۱)
بایگانی
- ارديبهشت ۱۳۹۳ (۱۴)
آخرین مطالب
پربیننده ترین مطالب
محبوب ترین مطالب
مطالب پربحثتر
پیوندهای روزانه
جهت دریافت فایل پی دی اف لیست دروس بر روی لینک زیر کلیک نمائید
واکنش بعدی در تراکم آلدولی که بطور خود بخودی اتفاق می افتد حذف گروه هیدروکسی از موقعیت بتا (حذف آب) و ایجاد ترکیب کربونیل غیر اشباعی آلفا و بتا میباشد.
اگر مخلوط آلدئیدها و یا کتونهای متفاوت و یا هر دوی آنها در محیط حضور داشته باشند، منجر به تولید محصولات تراکمی متنوع میشود. در مورد کتونهای دارای دو گروه متیلن یا در حالت خاص دو گروه متیل مثل استون اگر نسبت مولی بنزآلدئید به استون به صورت 2 به 1 باشد دی بنزال استون به جای بنزال استون تشکیل میشود.
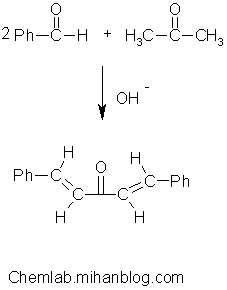
روش کار
در یک ارلن 150 سی سی 20 سی سی محلول سود 10% و 20 سی سی اتانول 95% بریزید . محلول را کاملا سرد کرده (برای جلوگیری از واکنشهای جانبی و کانیزارو) و 3 سی سی استون (4 صدم مول) و بلافاصله 8 سی سی بنزآلدئید اضافه کنید. رسوب زرد بلافاصله تشکیل میشود. به مدت 15 دقیقه مخلوط واکنش را به هم بزنید و سپس توسط قیف بوخنر صاف کنید روی صافی را با کمی آب سرد و سپس کمی اتانل 95% بشوئید. رسوب را با اتانل 95% و یا اتیل استات تبلور مجدد کنید و بگذارید خشک شود.
نقطه ذوب و بازده را حساب کنید.
مکانیسم

تبلور مجدد
تبلور مجدد یکی از بهترین روش های خالص سازی برای خالص کردن یک جامد است.در این روش اختلاف در حلالیت سبب جدا شدن اجسام از یک دیگر و یا سبب جدا شدن ناخالصی از یک جسم میشود.در تبلور مجدد مولکول ها به تدریج از محلول جدا شده و در ردیف های منظمی به یکدیگر متصل می گردند که به عنوان شبکه شناخته می شوند. در این روش ساختمان بلورین جسم جامد را با انحلال در حلال مناسب بطور کامل از بین می برند و سپس اجازه می دهند تا بلورهای جسم به صورت یک شبکه بلوری مجددا تشکیل شوند.نا خالصی ها معمولا در محلول باقی می مانند.
تبلور مجدد شامل چندین مرحله می باشد:
۱)انتخاب حلال مناسب
۲)انحلال جسم مورد تخلیص در نقطه جوش یا نزدیک آن
۳)صاف کردن محلول داغ برای جدا نمودن ناخالصی های نامحلول
۴)تبلور از محلولی که در حال سرد شدن است
۵)جدا کردن بلورها از محلولی که در آن شناور هستند
۶)شستشوی بلورها برای خارج کردن محلولی که به آنها آغشته است
۷)خشک کردن بلورها
حلال مورد نیاز برای تبلور مجدد باید دارای چندین خصوصیت باشد:
۱)مهمترین ویژگی حلال این است که جسم جامد مورد نظر را در دمای آزمایشگاه در خود حل نکند و در نقطه جوش در خود حل کند
۲)در دمای بالا ناخالصی را در خود حل نکند ا در دمای پایین در خود حل کند
۳)نقطه جوش خیلی پایینی نداشته باشد
۴)بهتر است نقطه جوش حلال کمتر از نقطه ذوب جسم باشد
۵)حلال یا جسم مورد نظر واکنش شیمیایی ندهد
۶)حلال از درجه سمی بودن پایینی برخوردار بوده و از لحاظ اقتصادی مقرون به صرفه باشد.مثلا از آب,الکل و کلروفرم که همگی شرایط لازم برای تبلور را دارند استفاده کنند
اگر نیاز به انتخاب حلال مناسب برای تبلور مجدد داریم به روش زیر عمل می کنیم:
ابتدا چند لوله آزمایش را بر می داریم و مقداری (حدود چند بلور شکر ) از جسم جامد را درون آن می ریزیم.سپس یک میلی لیتر از حلال هایی را که در اختیار داریم در هر کدام از لوله ها می ریزیم و آنها را شدیدا تکان می دهیم آنگاه می بینیم که آیا جسم در حلال حل شده است یا خیر؟ در مرحله بعد لوله ها را تا رسیدن به نقطه جوش حرارت می دهیم و باز نگاه می کنیم که آیا جسم در حلال حل شده است یا خیر؟ و نتایج را ثبت می کنیم.ما دنبال حلالی می گردیم که در دمای آزمایشگاه جسم را در خود حل نکند و در دمای جوش بتواند جسم را در خود حل کند.معمولا از آب به عنوان یک حلال مناسب استفاده می کنند.در صورتی که آب به عنوان حلال مناسب برای تبلور مجدد باشد می توان عمل انحلال را در یک بشر و در فضای باز انجام داد در غیر این صورت برای اجتناب از استنشاق گازهای سمی عمل انحلال باید در یک بالن و یا با استفاده از یک مبرد و به صورت رفلاکس انجام گیرد.
شرح آزمایش:
یک بشر برداشته و حدود یک گرم استانیلید ناخالص را درون آن می ریزیم و به آن حدود ۲۰ میلی لیتر آب اضافه میکنیم و حرارت ککیدهیم تا به جوش آید.در صورتی که جسم به صورت کامل حل نشد هر بار به آن ۱۰ میلی لیتر آب اضافه نموده ومجددا حرارت می دهیم تا به جوش آید.مدت زمان جوشیدن نبایستی طولانی شود چون حلال اضافه شده تبخیر می گردد.افزایش حلال را تا زمانی که تمام جسم در دمای جوش حل شود ادامه می دهیم البته پس از هر بار افزودن حلال اگر اجسامی که به نظر می آید ناخالص باشند (موادی پرز مانند ) در دمای جوش حل نشدند حدود ۱۰ میلی لیتر حلال اضافه تر می ریزیم و آن را به صورت داغ روی یک کاغذ صافی معمولی صاف می کنیم در این مرحله نبایستی صاف کردن با استفاده از مکش انجام گیرد چون جریان هوا باعث سرد شدن حلال گردیده و کریستالها نا به هنگام تشکیل میگردند.افزایش حلال اضافه به منظور جلوگیری از تبلور نا به هنگام در این مرحله می باشد.بهتر است در این مرحله در حین صاف کردن بشر را مرتبا به طور ملایم حرارت دهیم . افزایش حلال خیلی بیش از مقدار مورد نیاز ممکن است که مانع تشکیل رسوب گردد.
محلول (صاف شده ) را در کناری قرار داده تا به مرور زمان سرد شده و بلور های جسم تشکیل گردند.هنگام سرد شدن محلول نبایستی آن را به هم زد چون باعث می شود که بلورهای ریزی به دست آید .پس از تشکیل کامل بلورها این مجموعه را روی کاغذ صافی معمولی یا روی قیف بوخنر صاف کرده تا جسم بر روی کاغذ صافی باقی بماند.ناخالصی هایی که در دمای بالا نا محلول هستند را با صاف کردن محلول های داغ و ناخالصی هایی که در دمای پایین محلول هستند را از طریق صاف کردن محلول سرد جداسازی می نماییم.
پس از صاف کردن بلورها معمولا می توان مقدار دیگری بلور به دست آورد . برای این کار میتوان محلول زیر صافی را در حمام آب یخ قرار داد یا ابتدا کمی آن را حرارت داده تا مقداری از حلال آن خارج شده و تغلیظ شود و سپس اجازه دهیم تا متبلور شود . بلورهایی که در این مرحله به دست می آید به اندازه مرحله اول خالص نیستند.
به منظور شستن بلورها می توان مقداری از حلال سرد ( در اینجا آب ) را روی کریستالهای جسم ریخته و اجازه داد تا حلال شستشو از بلورها خارج شود.
در صورت استفاده از خرطوم آبی می توان برای خشک کردن سریع تر بلورها چند دقیقه هوا را از درون بلورهای موجود در قیف عبور داد و سپس آنها را روی شیشه ساعت قرار داده و برای چند ساعت در هوا قرار داد. در صورت لزوم می توان از آون برای خشک کردن بلورها استفاده نمود و یا با گذاشتن این بلورها در دسیکاتور خلا سرعت خشک کردن آنها را تسریع نمود.
اندازه گیری نقطه جوش
تعریف نقطه جوش:نقطه جوش دمایی است که در آن دما, فشار بخار جسم مایع با فشار اتمسفر برابر می شود.
نقطه جوش به عوامل زیر بستگی دارد:
۱_ فشار: بین نقطه جوش وفشار ارتباط مستقیم وجود دارد . اگر به تعریف نقطه جوش دقت شود فشار سیستم بالا رود نقطه جوش نیز بالا می رود و بالعکس.
تاثیر فشار بر نقطه جوش:
نقطه جوش یک مایع با تغییر فشار خارجی تغییر میکند. نقطه جوش نرمال یک مایع ، دمایی است که در آن فشار بخار مایع برابر با یک اتمسفر باشد . نقطه جوش داده شده در کتابهای مرجع ، نقاط جوش نرمال میباشند . نقطه جوش یک مایع را میتوان از منحنی فشار بخار آن بدست آورد و آن دمایی است که در آن فشار بخار مایع با فشار وارد بر سطح آن برابری میکند.
نوسانات فشار جو در یک موقعیت جغرافیایی ، نقطه جوش آب را حداکثر تا Cْ ۲ تغییر میدهد . ولی تغییر محل ممکن است باعث تغییرات بیشتر شود ، متوسط فشاری که هواسنج در سطح دریا نشان میدهد یک اتمسفر ، ولی در ارتفاعات بالاتر کمتر از این مقدار است. مثلا در ارتفاع ۵۰۰۰ پایی از سطح دریا متوسط فشاری که فشارسنج نشان میدهد atm 0.836 است و نقطه جوش آب در این فشار Cْ ۹۵٫۱ میباشد.
مولکولها در فاز گازی به سرعت حرکت میکنند و دائما به دیواره ظرف بر می خورند و منجر به وارد کردن فشار به دیواره آن می شوند میزان این فشار در یک درجه حرارت معین را فشار بخار تعادل جسم مایع در آن درجه می نامند . این فشار بخار به درجه حرارت بستگی دارد . این بستگی به آسانی با تمایل گریز مولکولها از مایع قابل توجیه است. با ازدیاد درجه حرارت انرژی جنبشی متوسط مولکولها افزایش می یابد و فرار آنها به فاز گازی آسان میشود . سرعت ورود مجدد مولکولها نیز رو به افزایش می رود و به زودی در درجه حرارت بالاتر تعادل برقرار می شود. ولی در این حال تعداد مولکولها در فاز گازی از تعداد آنها در درجه حرارت پایین تر بیشتر است و در نتیجه فشار بخار زیادتر است .
اکنون نمونه مایعی را در نظر بگیرید که در یک درجه حرارت معین در ظرف سر گشاده ای قرار دارد و مولکولهای فاز بخار در بالای مایع می توانند از محوطه ظرف خارج شوند . بخاری که در بالای این نمونه است از مولکولهای هوا و نمونه تشکیل شده است . طبق قانون فشارهای جزئی دالتون ، فشار کل (خارجی) در بالای مایع برابر با فشارهای جزئی نمونه و هوا است :
هواP + نمونهP = کلP
فشار جزئی نمونه برابر با فشار بخار تعادل آن در درجه حرارت معین است. اگر درجه حرارت بالا رود (بدین ترتیب فشار بخار تعادل نمونه زیاد میشود) تعداد مولکولهای نمونه در فضایی که در بالا و نزدیک مایع است افزایش می یابد و در نتیجه مقداری از هوا جابجا میشود . در درجه حرارت بالا فشار جزئی نمونه درصد بیشتری از فشار کل را تشکیل میدهد . با ازدیاد بیشتر درجه حرارت این عمل ادامه می یابد تا فشار بخار تعادل با فشار خارجی برابر شود و در این حال تمام هوا کاملا از ظرف خارج میشود . تبخیر بیشتر باعث جابجا شدن مولکولهای گازی نمونه خواهد شد . با توجه به این حقایق به این نتیجه میرسیم که فشار بخار تعادل یک نمونه یک حد نهایی دارد که به وسیله فشار خارجی معین میشود . در این حد سرعت تبخیر به مقدار زیادی افزایش می یابد (که با تشکیل حباب در مایع آشکار میشود) و این مرحله را عموما شروع جوشش می دانند. نقطه جوش یک مایع درجه حرارتی است که در آن فشار بخار مایع کاملا برابر با فشار خارجی شود. چون نقطه جوش مشاهده شده مستقیما به فشار خارجی بستگی دارد، از این جهت باید در گزارش نقطه جوش، فشار خارجی هم قید شود (مثلا نقطه جوش ۱۵۲ درجه سانتیگراد در فشار ۷۵۲ میلی متر جیوه). معمولا نقطه جوش استاندارد را در فشار آتمسفر (۷۶۰ mm Hg) تعیین میکنند .
نقاط جوش برای شناسایی مایعات و برخی از جامداتی که در حرارت پایین ذوب میشوند، مفید هستند. جامداتی که در حرارت بالا ذوب میشوند معمولا آنقدر دیر میجوشند که نمیتوان به راحتی درجه جوش آنها را اندازه گرفت .
۲_ ساختمان ترکیب: هر چقدر ساختمان ترکیب قطبی تر باشد نقطه جوش هم بیشتر می شود .اگر ترکیبی توانایی تشکیل پیوند هیدروژنی را داشته باشد نقطه جوش آن بالاتر می رود . ملاحظه می شود که در دو ترکیب H2S و H2O اتم های مرکزی هم گروه می باشند ولی چون مولکول های آب توانایی تشکیل پیوند هیدروژنی دارد نقه جوش آن بالا تر خواهد بود.
هرچقدر ترکیبی دارای شاخه های جانبی کمتری باشد نقطه جوش آن بیشتر خواهد بود
۳_ ناخالصی ها: ناخالصی ها دو نوع اند:
الف)غیر فرار : مثل ترکیبات معدنی مانند Mgcl2 , Nacl که باعث افزایش نقطه جوش می شوند.
ب) فرار: ترکیبات فرار بسته به نوع ناخالصی می توانند هم باعث افزایش دمای جوش و یا کاهش آن شوند .
چگونگی جوشیدن یک مایع
وقتی که فشار بخار یک مایع با فشار جو برابر می شود، مایع شروع به جوشیدن میکند . در این دما ، بخار حاصل در داخل مایع سبب ایجاد حباب و غلیان خاص جوشش میشود . تشکیل حباب در دمای پایینتر از نقطه جوش غیر ممکن است ، زیرا فشار جو بر سطح مایع که بیش از فشار داخل آن است ، مانع از تشکیل حباب میشود . دمای مایع در حال جوش تا هنگامی که تمام مایع بخار نشده است ، ثابت میماند در یک ظرف بدون درپوش حداکثر فشار بخاری که هر مایع میتواند داشته باشد برابر با فشار جو میباشد .
فشار بخار هر مایع تنها از روی دما معین میشود . بنابراین اگر فشار بخار ثابت باشد دما نیز ثابت است . برای ثابت ماندن دمای یک مایع در حال جوش باید به آن گرما داده شود. زیرا در فرایند جوش مولکولهای با انرژی زیاد از مایع خارج میشوند. اگر سرعت افزایش گرما بیش از حداقل لازم برای ثابت نگهداشتن دمای مایع در حال جوش باشد، سرعت جوشش زیاد میشود ولی دمای مایع بالا نمی رود.
روش های تعیین نقطه جوش:
به دو روش می توان نقطه جوش مواد را مشخص کرد : ۱) روش میکرو . ۲) روش ماکرو
تفاوت این دو روش در مقدار ماده ای است که در اختیار داریم . روش میکرو به مقدار کمی ماده نیاز دارد و از دستگاه های سادهه و به شکل ساده استفاده می شود.
دمای جوش
در میان هیدروکربنها به نظر میرسد که عوامل تعیین کننده دمای جوش ، عمدتا وزن مولکولی و شکل مولکولی باشند ؛ این چیزی است که از مولکولهایی که عمدتا با نیروهای واندروالسی در کنار یکدیگرند ، انتظار میرود . در الکلها نیز با افزایش تعداد کربن ، دمای جوش بالا میرود و با شاخهدار شدن زنجیر ، دمای جوش پایین میآید. اما نکته غیر عادی ، در مورد الکلها این است که آنها در دمایی بالا به جوش میآیند . این دماهای جوش ، بسیار بالاتر از دمای جوش هیدروکربنها با وزن مولکولی یکسان است و حتی از دمای جوش بسیاری ترکیبها با قطبیت قابل ملاحظه بالاتر است . چگونه این پدیده را تبیین میکنیم؟ بدیهی است پاسخ این است که الکلها ، همانند آب ، مایعهای بهم پیوسته هستند . دمای جوش بالای آنها به علت نیاز به انرژی بیشتر برای شکستن پیوندهای هیدروژنی است که مولکولها را در کنار یکدیگر نگه داشتهاند . اگر چه اترها و آلدئیدها هم اکسیژن دارند ، اما هیدروژن در آنها فقط با کربن پیوند دارد ، این نوع هیدروکربنها آنقدر مثبت نیستند که بتوانند با اکسیژن ، پیوند قابل ملاحظه ای ایجاد کنند
شرح آزمایش (روش میکرو ):
ابتدا یک لوله مویین بر می داریم و یک طرف آن را روی شعله مسدود می کنیم سپس لوله مویین را از وسط دو تکه می کنیم. لوله هایی که یک سمت آن مسدود شده است مورد نیاز ماست.یک لوله آزمایشی بر می داریم و لوله مویین مورد نظر را از سر باز وارد لوله آزمایش می کنیم . حدود ۱ الی ۵/۱ سی سی از مایع مورد نظر که می خواهیم نقطه جوش آن را تعیین کنیم داخل لوله آزمایش می ریزیم. سپس توسط یک چسب نواری لوله آزمایش را به یک دما سنج متصل می کنیم بطوریکه مخزن جیوه ای دماسنج مماس با انتهای لوله آزمایش قرار گیرد. مجموعه خود را توسط گیره متصل به سه پایه وارد حمام دما قرار می دهیم تا حرارت غیر مستقیم ببیند.
ما در اینجا از حمام آب گرم استفاده می کنیم (می توانیم نتیجه بگیریم که دمای جوش مایع مورد نظر از ۱۰۰ درجه کمتر است.) وقتی کل سیستم آماده شد حرارت را روشن می کنیم آنقدر حرارت می دهیم تا از انتهای لوله مویین داخل لوله آزمایش حباب خارج شود.حبابها ابتدا با سرعت کم وتعداد کم خارج می شود ولی پس از گذشت زمان تعداد و سرعت آنها افزایش می یابد. وقتیکه حباب ها بصورت یکپارچه و متوالی خارج شدند حرارت را قطع می کنیم . اگر با شعله کار می کنیم تنها کشیدن شعله از زیر بشر کافیست ولی اگر با Heater کار میکنیم باید کاملا بشر را از روی آن جدا کنیم و تنها خاموش کردن Heater کافی نیست. با قطع کردن حرارت حمام سرد شده و دمای مایع مورد نظر کاهش می یابد لذا تعداد حباب ها کم می شود تا زمانیکه تمام می شوند. لحظه ای که هیچ حبابی خارج نشود و مایع مورد نظر از لوله مویین شروع به بالا رفتن کند باید دما خوانده شود و ثبت گردد . این دما نقطه جوش ما خواهد بود.
ما این کار را بر اساس تعریف نقطه جوش انجام می دهیم چون ما آنقدر به مجموعه حرارت می دهیم تا مایع به جوش آمده و حباب از آن خارج شود . خارج شدن حباب ها نشان دهنده آن است که فشار بخار مایع از فشار اتمسفر بیشتر است. وقتی حرارت را قطع می کنیم تعداد حباب ها کم می شود تا لحظه ای که دیگر هیچ حبابی خارج نمی شود و این به معنی آن است که فشار بخار مایع کاهش می یابد تا لحظه ای که با فشار اتمسفر برابر می شود بنابراین اگر ما این لحظه را ثبت کنیم همان دمای نقطه جوش خواهد بود.
تئوری:
|
شناسنامه |
|
|
نام گذاری آیوپاک |
Benzoic acid |
|
جرم مولی |
۱۲۲٫۱۲ گرم بر مول |
|
نما(ظاهر) |
جامد سفید |
|
دمای ذوب |
۱۲۲٫۴ درجه سانتیگراد |
|
دمای جوش |
۲۴۹٫۲ درجه سانتیگراد |
|
چگالی |
۱٫۲۶۵۹ گرم بر میلی لیتر (در ۱۵ درجهٔ سلسیوس) |
|
فشار بخار |
Not available |
|
pH |
۳٫۰ محلول یک درصد |
|
حلالیت در آب |
کم محلول در آب سرد |
|
چگالی نسبی بخار |
۴٫۲۱ (نسبت به هوا) |
بنزوئیک اسید، (C7H6O2 (C6H5COOH، یک ترکیب بلوری بی رنگ (سفید دیده میشود) است. بنزوئیک اسید سادهترین کربوکسیلیک اسید آروماتیک نیز میباشد. این ماده یک اسید ضعیف محسوب میشود. از نمکهای آن به عنوان نگهدارندههای غذایی استفاده میشود، همچنین در ساخت بسیاری از ترکیبات آلی دیگر از بنزوئیک اسید استفاده میشود.
تاریخچه
بنزوئیک اسید در قرن شانزدهم میلادی کشف شد. اولین بار شخصی به نام Nostradamus از تقطیر خشک مادهای سنتی به نام gum benzoin بدست آورد. در سال ۱۸۷۵ شخصی به نام Salkowski نیز پی به خواص ضد قارچ بنزوئیک اسید برد.
روشهای تهیه
روش تجاری
یکی از روشهای تجاری ساخت بنزوئیک اسید، اکسایش جزئی تولوئن با گاز [
[اکسیژن]] در مجاورت کاتالیزور کبالت یا منگنز نفتنات است که با بازده بالا و رعایت اصول محیط زیستی (شیمی سبز) انجام میشود که تصویر واکنش مربوطه را در زیر میبینید

روش آزمایشگاهی
بنزوئیک اسید مادهٔ ارزان قیمت و در دسترسی است، در نتیجه در صورت نیاز به آن لازم نیست زحمت سنتز آن را متقبل شویم و فقط کافی است نمونهٔ تجاری آن را خریداری کرده و متناسب با کارمان آن را خالص سازی کنیم. که برای اینکار استفاده از روش تبلور مجدد با دو حلال با حلالهای اتانول و آب بسیار مناسب میباشد. ولی در هر صورت میتوان آن را به روشهای
زیر نیز سنتز کرد:
با هیدرولیز
از هیدرولیز بنزونیتریل، بنزآمید در محیطهای اسیدی و یا بازی شدید میتوان بنزوئیک اسید یا آنیون آن را بدست آورد
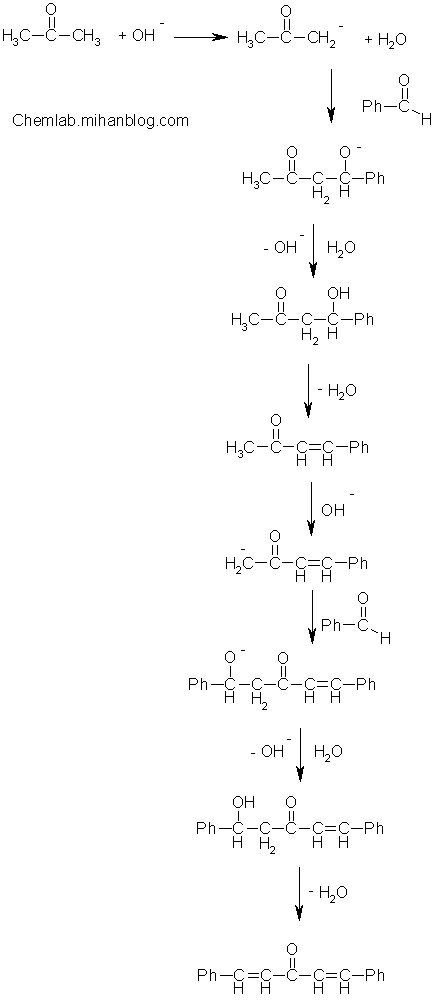
از بنزالدهید
همچنین میتوان با استفاده از واکنش کانیزارو ی تقاطعی بنزوئیک اسید را از بنزالدهید ساخت که واکنش مربوط به آن را در زیر میبینید:

از بنزیل الکل
همچنین میتوان از اکسایش بنزیل الکل در حضور محلول پتاسیم پرمنگنات داغ نیز استفاده کرد. در این روش بلافاصله بعد از واکنش باید محلول در حالت داغ فیلتر شود تا منگنز دی اکسید تشکیل شده جدا شود و سپس محلول به حال خود رها میشود تا بلورهای بنزوئیک اسید تشکیل شود.
مصارف
به عنوان خوراک واحدهای صنعتی
برای تهیهٔ بنزیل کلرید
بنزیل کلرید (C6H5COCl) از واکنش تیونیل کلرید (یا پنتاکلرید فسفر یا تری کلرید فسفر یا فسژن) با بنزوئیک اسید به دست میآید. با استفاده از بنزیل کلرید میتوان بسیاری از مشتقات بنزوئیک اسید را ساخت از جمله بنزیل بنزوآت که یک طعم دهندهٔ مصنوعی میباشد.
برای تهیهٔ فنول
فنول (C6H5OH) از کربوکسیل زدایی همراه با اکسایش در دمای ۳۰۰oC الی ۴۰۰oC بدست میآید. البته این فرایند میتواند در حضور کاتالیزور نمک کبالتII در ۲۰۰oC هم انجام پذیرد. فنول (Phenol) نیز استفادههای بسیاری دارد، که مهمترین آنها تبدیل فنول به سیکلوهگزانول میباشد که سرآغازی برای تولید نایلون است.
وبرای ساخت بسیاری مواد دیگر
نگهدارندهٔ غذا
بنزوئیک اسید و نمکهایش به عنوان نگهدارندهٔ غذا مصرف دارند که به نامهای E۲۱۲، E۲۱۱، E۲۱۰ و E۲۱۳ شناخته میشوند. هر کدام از این نمکها از واکنش مستقیم یا واکنش با نمکهای سدیم، پتاسیم یا کلسیم تهیه میشوند. در اصل بنزوئیک اسید از رشد قارچها، مخمرها و بعضی باکتریها جلوگیری میکند. نحوهٔ اثر بنزوئیک اسید اینگونهاست که در ابتدا بنزوئیک اسید جذب سلول میشود، اگر pH درون سلولی به ۵ یا کمتر تغییر کند، تخمیر ناهوازی گلوکز از طریق Phosphofructokinase به میزان ۹۵٪ کاهش مییابد و این خود باعث نابودی آنها میشود. مقدار معمول استفاده از بنزوئیک اسید و نمکهایش به عنوان نگه دارنده بین ٪۰٫۰۵-٪۰٫۱ میباشد. البته در بعضی غذاها باید از سطوح بالاتری از بنزوئیک اسید استفاده شود که مقادیر ماکسیمم آن در قوانین بین المللی غذا موجود است. البته نگرانیهایی وجود دارد مبنی بر اینکه بنزوئیک اسید با آسکوربیک اسید (ویتامین C) موجود در نوشابهها واکنش داده و مقادیر بسیار کم (ولی در دراز مدت خطرناک) بنزن تولید میشود.
دارو
اسید بنزوئیک جزئی از پماد Whitfield است که برای درمان بیماریهای قارچی پوست و مو استفاده میشود.
خطرات بنزوئیک اسید
بنزوئیک اسید یک محرک پوست و چشم است. پس باید از تماس آن با پوست و چشم احتراز شود
شرح آزمایش
یک بالن ته گرد فاقد شاخه ی جانبی را برداشته ۳g پرمنگنات پتاسیم .۵۰cc آب مقطر . ۲ml سود غلیظ و ۴cc تولوئن را در آن ریخته چند گرم سنگ جوش به آن اضافه کرده به مدت ۶۰ دقیقه تقطیر برگشتی را انجام داده سپس محتوی را در یک بشر ریخته و با اسید سولفوریک اسیدی کرده و سپس به آن سولفیت سدیم جامد اضافه کرده تا رنگ محلول زایل گردد.روی بن ماری قرار داده تا حجم نصف شود سپس بشر را به کناری گذاشته تا سرد شود و اسیدبنزوئیک متبلور شود.سپس بوسیله ی قیف بوخنر و پمپ خلا صاف کرده و با آب مقطر کم حل کرده و مجددا کریستاله نموده آنگاه پس از خشک شدن مقدار آن را به دست آورید.
بنزوات سدیم (E۲۱۱) دارای فرمول شیمیایی NaC۶H۵CO۲ است. این ماده نمک اسید بنزوئیک است و به همین شکل محلول در آب است. میتوان آن را از ترکیب هیدروکسید سدیم و اسید بنزوئیک تولید کرد.
مصارف
سدیم بنزوات یک مادهی نگهدارندهی غذایی است و در محیط اسیدی از فعالیت باکتریها و قارچها جلوگیری میکند. این ماده بیش از همه در غذاهای اسیدی مثل چاشنیهای سالاد (سرکه)، نوشابههای گازدار (اسید کربنیک)، مرباها و آبمیوهها (اسید سیتریک)، ترشیجات (سرکه)، و سسها استفاده میشود. همچنین در مواد دیگر مانند برخی داروها و شامپوها نیز به کار میرود. سدیم بنزوات را بر روی محصول با همین نام یا E۲۱۱ مشخص میکنند.
این ماده همچنین در مواد آتشبازی به عنوان سوخت ترقههای موشکی بهکار میرود زیرا بهسرعت میسوزد و صدای سوت تولید میکند.
بنزوات سدیم از خنثیسازی اسید بنزوئیک توسط هیدروکسید سدیم حاصل میشود. اسید بنزوئیک به مقادیر کم در آلو، گوجه، دارچین، میخک، و سیب یافت میشود. با این که اسید بنزوئیک نگهدارندهی مؤثرتری است اما معمولاً از بنزوات سدیم به عنوان نگهدارنده غذایی استفاده میشود زیرا اسید بنزوئیک بهخوبی در آب حل نمیشود. غلظت مجاز به عنوان نگهدارنده غذایی توسط FDA به ۰٫۱٪ وزنی محدود شدهاست. برنامهی بینالمللی ایمنی شیمیایی برای دزهای ۶۴۷–۸۲۵ mg/kg وزن بدن در روز تأثیر منفیای شناسایی نکرد.
گربهها تحمل خیلی کمتری در مقابل اسید بنزوئیک و نمکهای آن نسبت به موشها دارند. با این حال بنزوات سدیم بهعنوان افزودنی در غذای حیوانات تا مقادیر ۰٫۱٪ توسط AFCO مجاز اعلام شدهاست.
مکانیسم نگهدارندگی غذا
این مکانیسم با جذب اسید بنزوئیک توسط سلول آغاز میشود. اگر PH سلول به مقادیر ۵ یا کمتر کاهش یابد فرآیند تخمیر گلوکز توسط فسفوفروکتوکیناس تا ۹۵٪ کاهش مییابد.
سلامتی و ایمنی
بنزوات سدیم و بنزوات پتاسیم در ترکیب با اسید آسکوربیک (ویتامین ث، E۳۰۰) تولید بنزن میکنند، که یک سرطانزای شناختهشده است. با این حال، مقادیر آن کمتر از میزانی است که خطرناک شناخته میشود. حرارت، نور و زمان نگهداری میتوانند بر نرخ تولید بنزن تأثیرگذار باشند.
پروفسور پیتر پایپر در دانشگاه شفیلد معتقد است که بنزوات سدیم به تنهایی میتواند به اجزای حیاتی DNA در میتوکندری سلول آسیب برساند و آنها را غیرفعال کند. میتوکندری در سلول در تولید انرژی نقش دارد و اگر آسیب ببیند سلول مختل شده و ممکن است وارد آپوپتوز شود. بیماریهای زیادی امروزه به آسیب DNA نسبت داده میشود مانند پارکینسون و سایر بیماریهای نابودی مغز و اعصاب (آلزایمر، هانتینگتون و ...)، و از همه مهتر، کلاً فرآیند پیری.
بیشفعالی
مقالهای که در سال ۲۰۰۷م برای آژانس استاندارد غذایی (FSA) در انگلیس منتشر شد بیان کرد که برخی رنگهای مصنوعی هنگامی که بنزوات سدیم همراه شود میتواند با رفتار بیشفعالی در ارتباط باشد.
پروفسور جیم استیونسن از دانشگاه ساثمپتن و نویسندهای این مقاله میگوید: «این یک تحقیق عمده بوده است که روی موضوع مهمی انجام شده است. نتایج نشان میدهد که ترکیبات خاصی از رنگهای غذایی مصنوعی و نگهدارندهغذایی بنزوات سدیم با افزایش رفتار بیشفعالی در کودکان در ارتباط است. اما والدین نباید گمان کنند که با حذف این افزودنیها از غذای کودکان از بروز اختلال بیشفعالی جلوگیری میشود. ما میدانیم که عوامل دیگری هم نقش دارند اما این حداقل چیزی است که کودک میتواند از آن اجتناب کند»."
با بررسیهای بیشتر توسط FSA چنین بهنظر میرسید که فقط رنگهای خاصی در این مشکل نقش دارند.
در ۱۰ آوریل ۲۰۰۸ آژانس استاندارد غذایی خواستار حذف داوطلبانهی رنگها (اما نه بنزوات سدیم) تا پایان سال ۲۰۰۹ میلادی شد.[۱۶] بعلاوه پیشنهاد کرد که اقدامی برای حذف تدریجی این مواد از غذاها و نوشیدنیها در سطح اتحادیهی اروپا در طی زمانی معین باید صورت گیرد.
در پاسخ به تأکید مصرفکنندگان بر محصولات طبیعی و ارتباط E۲۱۱ با تخریب DNA و ADHA (اختلال کمتوجهی - بیشفعالی) شرکت کوکاکولا در حال حذف بنزوات سدیم از کوکای رژیمی است. این شرکت همچنین اعلام کرده است که قصد دارد E۲۱۱ را به محض این که جایگزین مناسبی برای آن یاف شود از سایر محصولات خود -- از جمله اسپرایت، فانتا و اویسیس -- نیز حذف کند.
تئوری :
کروماتوگرافی اصطلاحی است که به چندین تکنیک جداسازی اطلاق می گردد که اساس این روش ها مهاجرت افتراقی یا اصطلاحا(Defferential Migration) است .دراین تجربه یکی ازاین روشهایعنی کروماتوگرافی کاغذی به منظور جداسازی مخلوطی از یون های فلزات واسطه به کار می رود به طوری که شناسایی آن ها ممکن شود .خواهید دید که شناسایی هر یون پس از این که این یون هااز هم جدا شدند خیلی راحت تر خواهد بود .
درهر روش مهاجرت افتراقی سه چیز مورد نیاز است.
۱) بایستی یک محیط مهاجرت وجود داشته باشد که محلی است برای این که جدا سازی اتفاق بیافتد.
۲) بایستی یک نیروی جلو برنده (Driving Force)برای حرکت دادن گونه ها جهت جدا شدن در طول محیط مهاجرت وجود داشته باشد.
۳) بایستی یک نیروی مقاوم انتخابی (Selection Resistive Force)وجود داشته باشد.
تعریف نیروی متحرک (Driving Force): عبارتست از تمایل حل شدن گونه در فاز متحرک که باعث پیشروی سریع تر نمونه می شود.
تعریف نیروی مقاوم انتخابی(Selection Resistive Force): عبارتست از تمایل حل شدن گونه در فازثابت که باعث عقب ماندن آن از مهاجرت می شود.
همین نیروی اخیر یعنی نیروی مقاوم انتخابی است که باعث جدا سازی قابل ملاحظه گونه های شیمیایی می شود.
اگرمخلوط از گونه های شیمیایی روی یک محیط مهاجرت درنقطه ای قرارداده شوند ،نیروی جلوبرنده تمایل دارد که مخلوط را به مکانی دور تر از نقطه شروع حرکت دهد .از طرفی نیروی مقاوم انتخابی تمایل به عقب نگه داشتن گونه ها دارد .نیروی مقاوم مذکور از این نظر انتخابی است که حرکت هریک از گونه هارا با میزانی متفاوت کند می کند.
این اختلاف در سرعت حرکت در جهت دور شدن از مبداء،اساس اصطلاح (Defferential Migration) است.
دراین آزمایش روش مهاجرت افتراقی ،کروماتوگرافی کاغذی است . محیط مهاجرت نواری از کاغذ کروماتوگارفی است. نیروی جلوبرنده ،جریانی از مایع به عنوان حلال در طول نوار کاغذ است که این حلال مایع ،فاز متحرک یا (Mobile Phase)هم گفته می شود .درمورد نیروی مقاوم انتخابی این احتمال می رود که بیش از یک نوع نیروی مقاوم انتخابی درکاغذ کروماتوگرافی وجود داشته باشد. شاید یکی از نیروهای مقاوم انتخابی عمده وقتی شناخته شد که دریافتند کاغذ دارای مقدار زیادی آب است که محکم به آن چسبیده واین وضع ممکن است به صروت استخرهایی از آب تصور شود .وقتی گونهه های شیمیایی درحال حرکت در طول مسیر فاز متحرک هستند با مکان هایی پر از آب پیوند یافته به کاغذ مواجه می شوند .حتی ممکن است این گونه ها به داخل این فاز ثابت یا ساکن (Stationary Phase)حرکت کنند نظربه این که کسری از زمان که هر گونه جدا گانه ،درفاز ساکن سپری می کند بستگی به حلالیت نسبی آن گونه درهر دو فاز ساکن ومتحرک دارد واین حلالیت ها بستگی به ماهیت گونه شیمیایی دارد واین مسئله یک عمل مقاوم انتخابی را توصیف می کند .وقتی یک گونه درفاز متحرک است ،با سرعتی معادل سرعت فاز متحرک حرکت می کند .وقتی گونه درفاز ساکن است این چنین حرکتی ندارد .بنابراین گونه های شیمیایی مختلف در یک نمونه معین به علت این که باسرعت های متفاوتی درجهت ددور شدن از مبدا حرکت می کنند جدا می شوند.
واضح است که برای یک زوج معین از فازهای ساکن ومتحرک ،کسری ازفاصله که گونه شیمیایی طی می کند یسبت به فاصله ای که فاز متحرک طی می کند ثابت خواهد بود. این کسر که مقدار Rf گونه مورد نظر نامیده می شود ،ممکن است به منظور مقایسه دو کورماتوگرام مورد استفاده قرارگیرد هرچند که ممکن است فازمتحرک دردو کروماتوگرام به اندازه های متفاوتی پیشروی کرده باشد.
هرچند که کروماتوگرافی با کاغذ ،وسیله توانایی برای جدا سازی گونه های شیمیایی است اغلب گونه ها ری کروماتوگرام قابل رویت نیستند .به این دلیل اغلب لازم است کروماتوگرام را با واکنشگرهایی که با گونه هایی شیمیایی مورد نظر واکنش داده وترکیبات رنگین تولید می کنند اثر دهیم .
تاریخچه
برای اولین بار در سال ۱۹۰۵ میلادی چوگایف دانشمند روسی واکنش دیمتیل گلیاکسیم با یون نیکل را کشف کرد
و از آن برای شناسایی و اندازهگیری یون نیکل استفاده نمود. ولی توسعه واقعی و سریع واکنشگرهای آلی و استفاده از آنها در شیمی تجزیه از سال ۱۹۴۵ میلادی شروع شد. علت آن نیز گسترش صنایع نوین و اهمیت تجزیه مقادیر جزئی در این صنایع بود.
طبقهبندی واکنشگرهای رسوب دهنده
واکنشگرهای رسوب دهنده معدنی
مواد معدنی که محلول آنها برای رسوب دادن یونهای فلزی بکار میروند عبارتند از اسیدهای معدنی ضعیف یا قوی نظیرH2S,H3PO4,H2SO4,HCl یا نمکهای محلول آنها. اسید سولفوریک و سولفات هیدروژن یونها را به صورت سولفید رسوب میدهند، اسید سولفوریک برای رسوب دادن یون باریم و اسید هیدروکلریک برای رسوب دادن یون نقره استفاده میشود.
هیدروکسیدهای محلول نظیر سدیم و پتاسیم و آمونیاک برای رسوب دادن یونهای فلزی به صورت هیدروکسید بکار میروند. همچنین از یونهای فلزی هم میتوان به عنوان عامل رسوب دهنده آنیونهایی که با آنها رسوب کم محلول میدهند استفاده کرد.
واکنشگرهای رسوب دهنده آلی
واکنشگرهای آلی در شیمی تجزیه کاربردهای فراوان دارند. از این واکنشگرها در وزن سنجی ، تیترسنجی ، روش قطرهای و جذب سنجی استفاده میشود. واکنشگرهای رسوب دهنده آلی دارای عواملی هستند که بوسیله آنها مولکول واکنشگر با یونهای معدنی ترکیب میشود و این عوامل بیشتر خاصیت اسیدی دارند.
اطلاعات اولیه
پر کاربردترین شیوه جداسازی مواد تجزیهای کروماتوگرافی است که در تمام شاخههای علوم کاربردهایی دارد. کرماتوگرافی گروه گوناگون و مهمی از روشهای جداسازی مواد را شامل میشود و امکان میدهد تا اجزای سازنده نزدیک به هم مخلوطهای کمپلکس را جدا ، منزوی و شناسایی کند بسیاری از این جداسازیها به روشهای دیگر ناممکن است.
سیر تحولی رشد
· اولین روشهای کروماتوگرافی در سال ۱۹۰۳ بوسیله میخائیل سوئت ابداع و نام گذاری شد. او از این روش برای جداسازی مواد رنگی استفاده کرد.
· مارتین و سینج در سال ۱۹۵۲ به پاس اکتشافاتشان در زمینه کروماتوگرافی جایزه نوبل دریافت کردند.
توصیف کروماتوگرافی
کروماتوگرافی را به دلیل اینکه در برگیرنده سیستمها و تکنیکهای مختلفی است نمیتوان به طور مشخص تعریف کرد. اغلب جداسازیها بر مبنای کروماتوگرافی بر روی مخلوطهایی از مواد بیرنگ از جمله گازها صورت میگیرد. کروماتوگرافی متکی بر حرکت نسبی دو فاز است ولی در کروماتوگرافی یکی از فازها بدون حرکت است و فاز ساکن نامیده میشود و دیگری را فاز متحرک مینامند. اجزای یک مخلوط به وسیله جریانی از یک فاز متحرک از داخل فاز ساکن عبور داده میشود. جداسازیها بر اساس اختلاف در سرعت مهاجرت اجزای مختلف نمونه استوارند.
روشهای کروماتوگرافی
روشهای کروماتوگرافی را میتوان ابتدا بر حسب ماهیت فاز متحرک و سپس بر حسب ماهیت فاز ساکن طبقهبندی کرد. فاز متحرک ممکن است گاز یا مایع و فاز ساکن ممکن است جامد یا مایع باشد. بدین ترتیب فرآیند کروماتوگرافی به چهار بخش اصلی تقسیم می شود. اگر فاز ساکن جامد باشد کروماتوگرافی را کروماتوگرافی جذب سطحی(Adsorption Chromatography) و اگر فاز ساکن ، مایع باشد کروماتوگراف تقسیمی(Partition Chromatography) مینامند.
انواع کروماتوگرافی
هر یک از چهار نوع اصلی کروماتوگرافی انواع مختلف دارد:
· کروماتوگرافی مایع – جامد (Liquid – Solid Chromatography )
o کروماتوگرافی جذب سطحی (Adsorption Chromatography)
o کروماتوگرافی لایه نازک (Thin Layer Chromatography)
o کروماتوگرافی تبادل یونی (Ion-Exchange Chromatography)
o کروماتوگرافی ژلی (Gel Chromatography)
· کروماتوگرافی گاز – جامد (Gas- Solid Chromatography)
· کروماتوگرافی مایع – مایع(Liquid – Liquid Chromatography )
o کروماتوگرافی تقسیمی (Partition Chromatography)
o کروماتوگرافی کاغذی (Paper Chromatography)
· کروماتوگرافی گاز- مایع (Gas- Liquid Chromatography )
o کروماتوگرافی گاز – مایع ( Gas- Liquid Chromatography)
o کروماتوگرافی ستون مویین (Capillary Column Chromatography)
مزیت روشهای کروماتوگرافی
· با روشهای کروماتوگرافی میتوان جداسازیهایی را که به روشهای دیگر خیلی مشکل میباشند انجام داد. زیرا اختلافات جزئی موجود در رفتار جزئی اجسام در جریان عبور آنها از یک سیستم کروماتوگرافی چندین برابر میشود. هر قدر این اختلاف بیشتر شود قدرت جداسازی مواد بیشتر و برای انجام جداسازی مواد نیاز کمتری به وجود اختلافات دیگر خواهد بود.
· مزیت کروماتوگرافی نسبت به ستون تقطیر این است که نسبتا آسان میتوان به آن دست یافت با وجود اینکه ممکن است چندین روز طول بکشد تا یک ستون تقطیر به حداکثر بازده خود برسد ولی یک جداسازی مواد کروماتوگرافی میتواند در عرض چند دقیقه یا چند ساعت انجام گیرد.
· یکی از مزایای برجسته روشهای کروماتوگرافی این است که آنها آرام هستند. به این معنی که احتمال تجزیه مواد جداشونده به وسیله این روشها در مقایسه با سایر روشها کمتر است.
· مزیت دیگر روشهای کروماتوگرافی در این است که تنها مقدار بسیار کمی از مخلوط برای تجزیه لازم است به این دلیل روشهای تجزیهای مربوط به جداسازی مواد کروماتوگرافی میتوانند در مقیاس میکرو و نیمه میکرو انجام گیرند.
· روشهای کروماتوگرافی ساده سریع و وسایل مورد لزوم آنها ارزان هستند. مخلوطهای پیچیده را میتوان نسبتا به آسانی به وسیله این روشها به دست آورد.
مواد
نوع کروماتوگرافی
مواد شیمیایی مشابه
کروماتوگرافی تقسیمی
مواد شیمیایی غیر مشابه
کروماتوگرافی جذب سطحی
گازها و اجسام فرار
کروماتوگرافی گازی
مواد یونی و معدنی
کروماتوگرافی تبادل یونی در ستون کروماتوگرافی کاغذی یا لایه نازک الکترفورز ناحیهای
مواد یونی و غیر یونی
کروماتوگرافی تبادل یون یا ژلی
مواد زیستی و ترکیباتی با جرم مولکولی نسبی بالا
کروماتوگرافی ژلی الکتروفورز
انتخاب بهترین روش کروماتوگرافی
انتخاب نوع روش کروماتوگرافی بجز در موارد واضح (مانند کروماتوگرافی گازی در جداسازی مواد گازها) عموما تجربی است. زیرا هنوز هیچ راهی جهت پیش بینی بهترین روش برای جداسازی مواد اجسام مگر در چند مورد ساده وجود ندارد. در ابتدا روشهای سادهتر مانند کروماتوگرافی کاغذی و لایه نازک امتحان میشوند. زیرا این روشها در صورتی که مستقیما قادر به جداسازی مواد نباشند نوع سیستم کروماتوگرافی را که جداسازی مواد بوسیله آن باید صورت بگیرد، مشخص میکنند آنگاه در صورت لزوم از روشهای پیچیدهتر استفاده میشود. از فهرست زیر میتوان به عنوان یک راهنمای تقریبی استفاده کرد.
در جداسازیهای مشکل وقتی که روشهای ساده فاقد کارایی لازم هستند روش کروماتوگرافی مایع با کارایی بالا (HELC) می تواند جوابگو باشد.
کروماتوگرافی کاغذی (Paper Chromatography)
اطلاعات اولیه
انواع جداسازیهای مختلف و ساده بر روی کاغذ به عنوان پیشروان کروماتوگرافی کاغذی توصیف شدهاند. این سیستم معمولا به عنوان نمونه بارزی از سیستم تقسیمی در نظر گرفته میشود که در آن فاز ساکن آب است و به وسیله جذب سطحی بر روی مولکولهای سلولز قرار میگیرد و مولکولهای سلولز نیز به نوبه خود به وسیله ساختار الیافی کاغذ در وضعیتهای ثابت نگه داشته میشود. امروزه ، به هر حال ، مشخص شده است که جذب سطحی اجزای فاز متحرک و حل شوندهها و اثرات تبادل یون نیز نقشهایی را ایفا میکنند و کاغذ به هیچ عنوان تنها به صورت تکیه گاه بی اثر نیست.
سیر تحولی رشد
روش پیشنهادی رانگ در سال ۱۸۵۰ و فرآیندی که آن را تجزیه موئینهای مینامند، از جمله آنها میباشند. چنین روشهایی در واقع بیشتر شبیه کروماتوگرافی جذب سطحی بودند و کروماتوگرافی کاغذی به مفهوم فعلی ، گسترش سیستم تقسیمی است که به وسیله مارتین و سینج در سال ۱۹۴۱ ارائه شد. در سال ۱۹۴۴ کونسدن ، گوردن و مارتین اسیدهای آمینه و پپتیدهای موجود در محصول آبکافت ، پروتئین پشم را به وسیله روشی جدا کردند که در آن به جای ستون پودر از یک صفحه یا نوار کاغذی آویزان در داخل یک ظرف سرپوشدار استفاده شده بود.
کاربرد
در ابتدا کروماتوگرافی کاغذی برای جداسازی مخلوطهای مواد آلی به کار رفت. ولی بعد از آن ، عمدتا به وسیله برستال و پولارد و همکاران آنها ، برای جداسازی یونهای معدنی به سرعت به کار گرفته شد. هم آنیونها و هم کاتیونها را به وسیله این روش میتوان جدا کرد.
خصوصیت ویژه
یک خصوصیت ویژه روش کروماتوگرافی کاغذی این است که چیزی مربوط به محلول یا گاز خارج شده از ستون که در سیستمهای معمول مایع یا گاز با آن برخورد میکنیم وجود ندارد. ترکیبات جدا شده روی کاغذ مکانیابی و شناسایی میشوند در نتیجه ، جداسازی به طور نسبتا دائم در روی کاغذ ثبت میشود. در این روش اجزای جدا شده جمع آوری نمیشوند و احتیاجی به وسایل پیچیده کنترل پیوسته نیست. اندازه گیری کمی ترکیبات جدا شده را میتوان روی کاغذ انجام داد ولی اگر بخواهند اجرای را از کاغذ خارج کنند. تنها کار لازم این است که قسمت مربوط به هر یک از اجسام را از کاغذ ببرند و هر یک را به طور جداگانه بشویند.
طرح کلی روش
قطرهای از محلولحاوی مخلوطی که باید جدا شود را روی یک صفحه یا نوار کاغذ صافی در محل علامت گذاری شده قرار میدهند. در این محل ، قطره به صورت یک لکه حلقوی پخش میشود. وقتی که لکه خشک شده کاغذ را در یک ظرف مناسب سربسته طوری قرار دهند که یک سر آن در حلال انتخاب شده به عنوان فاز متحرک فرو رود. حلال از طریق الیاف کاغذ در نتیجه عمل موئینگی نفوذ میکند و نکته مهم این است که سطح کاغذ نباید کاملا به وسیله حلال پوشانده شود. زیرا در این صورت ، اصلا جدا سازی صورت نمیگیرد یا نواحی خیلی پخش میشوند.
وقتی که جبهه حلال مسافت مناسبی را طی کرد یا بعد از یک زمان از قبل تعیین شده ، کاغذ را از طرف بیرون آورده ، جبهه حلال را با علامتی مشخص میکنند و میگذارند تا صفحه خشک شود. وقتی که محلهای مناطق جدا شده آشکار شدند لازم است که هر یک از اجسام به طور جداگانه شناسایی شوند. در موارد ایدهآل ، هر جسم با واکنشگر مکانیاب ، رنگ مخصوصی میدهد که در مورد مواد معدنی بیشتر و درمورد مواد آلی کمتر مشاهده میشود. سادهترین روش شناسایی بر اساس مقدار Rf یعنی نسبت فاصله طی شده به وسیله جبهه حلال است.
خارج کردن جسم از کاغذ
روشهای ارائه شده مستلزم به کارگیری یک واکنشگر مکان یاب شیمیایی برای تعیین محل لکه هستند، و لکههای رنگی اساس ارزیابی را تشکیل میدهند. بعضی اوقات میتوان کمپلکس را شستشو داد و به وسیله روش رنگ سنجی تخمین زد، ولی اگر تغییر شیمیایی قابل قبول نباشد ماده تغییر نیافته را باید شستشو داد. عمل شستشو را میتوان با وارد کردن تکه کاغذ در یک حلال ، به وسیله استخراج در یک دستگاه سوکسیله ، یا با استفاده از آرایش خاصی ، که در کاغذ یک جریان نزولی کروماتوگرافی ایجاد مینماید، انجام داد. برای جداسازیهای معدنی تکههای کاغذ را میتوان به صورت خاکستر در آورده ، باقیماندهها را در اسید حل کرد. نتایج این روش به اندازه روش شستشو خوب نیستند. از اینرو محلولهای به دست آمده را میتوان به وسیله هر روش مناسبی تجزیه کرد، روشهایی که اغلب به دنبال روشهای کروماتوگرافی به کار میروند عبارتند از رنگ سنجی و قطبش نگاری.
پیدا کردن یک روش کروماتوگرافی ، که بتواند به طور کمی تمامی اجزای یک مخلوط را جدا کند، مطلقا ضروری نیست. ارزیابی کمی فلزات با قطبش نگاری و ارزیابی کمی مواد آلی مشکلتر از فلزات است زیرا ، برای مواد آلی ، روشهای موجود برای آزمایش محلول حاصل از شستشو محدودتر هستند. ارزیابی مواد آلی معمولا بر روی کاغذ صورت میگیرند و بنابراین ، لازم است که هر جسمی از اجسام دیگر به طور کمی جدا شود.
نقایص کروماتوگرافی کاغذی
لکههای چند تایی :در کروماتوگرافی یونها فلزی ، اگر دارای آنیونی متفاوت از آنیون موجود در محلول اولیه باشد، ممکن است رقابتی بین آنیونها برای یون فلزی وجود داشته باشد، که در نتیجه دو لکه به دست میآید که هر یک از آنها مربوط به یکی از نمکهای فلزی میباشد. ممکن است یون فلزی دو کمپلکس متفاوت با حلال ایجاد کند. در جدا سازیهای آلی ، ممکن است جسم دو شکل متفاوت وجود داشته باشد. به عنوان مثال یک آمینو اسید میتواند به صورت کاتیون و یون دو قطبی باشد.
· دنباله دار شدن:اگر مخلوط یه مقدار زیاد از حد روی کاغذ قرار داده شود، یا سرعت عبور حلال متفاوت باشد، جسم نمیتواند برای ایجاد یک لکه مجزا به تعادل برسد. در این صورت این لکه ، در سطح بزرگی از کاغذ پخش شده و از حلال در حال پیشروی عقب میماند. دنبالهدار شدن ممکن است به سبب اثرات جذبی سطحی تر ایجاد شود.
اثرات لبه یا کناره: لکهها خیلی نزدیک به کنار نوار ، ممکن است در امتداد کنار کاغذ پخش شوند، عمل نفوذ ممکن است به علت بالا بودن غلظت موضعی فاز متحرک در آن ناحیه ، و یا به علت بالاتر بودن سرعت تبخیر حلال در کنار کاغذ ، که منجر به اثرات تقسیمی غیرعادی میشوند، باشد.
روش کمی کروماتوگرافی کاغذی
کاربرد کمی این روش نه تنها احتیاج به یک جداسازی کمی ، بلکه مکانیابی و ارزیابی کمی اجسام موجود نیز دارد. یک جداسازی کیفی رضایت بخش ، الزاما برای کار کمی مفید نیست. اندازه گیری کمی را میتوان یا با سنجش مقدار جسم موجود در لکه روی کاغذ ، یا با خارج کردن جسم از کاغذ و تجزیه اجزای جدا شده به وسیله روشهای کمی متداول انجام داد. لکه اولیه از نمونه مناسب روی کاغذ قرار میدهند، خشک کردن لکه باید تحت شرایط استاندارد زمان و دما صورت گیرد.
در تهیه حلال باید دقت زیادی روی نسبتهای اجزای صورت گیرد، برقرار ساختن تعادل باید به طور استاندارد انجام گیرد، طول عبور حلال در تمامی نوبتها یکسان باشد، در طول آزمایش ، دما باید ثابت بماند، و خشک کردن ورقه باید در یک زمان و دمای استاندارد انجام گیرد. واکنشگر مکانیاب (در صورت استفاده از لکههای رنگی) باید به طریق کاملا تکرارپذیر افزوده شود. و هر عمل بعدی ، مانند خشک کردن یا قراردادن در معرض بخار آمونیاک ، باید در مدت استاندارد انجام گیرد. مقدار جسمی که در یک جداسازی کروماتوگرافی باید روی کاغذ قرار گیرد، متغیر است.
موارد استعمال کروماتوگرافی کاغذی
· منابع علمی مربوط به روشهای تجزیهای و بررسی ترکیبات طبیعی نشان میدهد که کروماتوگرافی کاغذی در هر رشتهای کاربرد دارد. با این همه ، این روش هنوز هم در جداسازیهای مواد با ماهیت زیستی وسیعترین کاربرد را دارد.
· کروماتوگرافی کاغذی اکثرا به عنوان یک وسیله تحقیقاتی به کار میرود، و به طور گستردهای در تجزیههای روزمره مخصوصا در جداسازیهای جدیدی که هیچ روش کلاسیک برای آنها وجود ندارد، نیز مورد استفاده قرار می گیرد. روش اخیر در مسائل کلینیکی و زیست شیمیایی ، جداسازی اسیدهای آمینه و پپتیدها در بررسی ساختارهای پروتئین کاربد دارد.
· آزمایش روزمره ادرار و سایر مایعات بدن برای اسید آمینه و قند ، جداسازی بازهای پورین و نوکلئوتیدها در آزمایش اسیدهای نوکلئیک ، جداسازی استرئیدها ، تجزیه عمومی ، تجزیه بسپارها ، تشخیص و ارزیابی فلزات در خاک ها و نمونه های زمین شناسیGeology ، بررسی ترکیبات فنلی در عصاره های گیاهی ، جداسازی آلکالوئیدها ، جداسازی ترکیبات علامت دار به وسیله رادیو ایزوتوپها ، کروماتوگرافی کاغذی برای جداسازی مواد فرار غیر فعال مانند هیدروکربنها و دیگری جداسازی اسیدهای چرب با فراریت بیشتر مناسب نمی باشد.
داده ها:
داده های این آزمایش عبارتند از :
۱) رنگ های مشاهده شده برروی کاغذ کروماتوگرام
۲) میزان پیشروی نمونه برحسب میلی متر Dion
3) میزان پیشروی حلال Dsolvent
4) یافتن مقادیر Rf با استفاده از فرمول
شرح کار : در این ازمایش ما از محلول الکل و آب مقطر استفاده می کنیم .به صورت cc40 که ۵۰% آن را آب مقطر و ۵۰% آن را الکل تشکیل می دهد در دیسکاتور می ریزیم و کاغذ کروماتوگراف را در ابعاد دسیکاتور می بریم و حدود ۱ سانتی متر از پایین یک خط راست می کشیم و بعد یک نقطه از ماده اریتروزین (قرمز) و یک نقطه ماده فلورسبین (زرد ) و یک قطره مخلوط دو ماده را روی خط راستی که با مداد روی کاغذ رسم کردیم معلوم و ایجاد می کنیم و بع کاغذ را به صورت لوله شده در داخل دسیکاتور می گذاریم که محلول آب و الکل نیز در داخل آن موجود است و بعد درب شیشه ای دسیکاتور را می گذاریم و منتظر می مانیم تا محلول به نقطه ای برسد که در انجا متوقف شود یا سرعتش کم شود بعد کاغذ را از داخل دسیکاتور برمی داریم و مکان نقطه ها را علامت گذاری می کنیم و اندازه گیری می کنیم .
توجه:به دلیل این که نفتالین جز مواد آلی قرار دارد این گزارش کار به طور کلی برای خالص سازی مواد آلی استفاده میشود
مقدمه
درآزمایشگاه شیمی آلی 1 عمده مطالب دررابطه باروش های تخلیص(خالص سازی)می باشد که از جمله مهترین این روش ها می توان به تقطیر،استخراج ،تصعیدوتبلوراشاره نمود.
تقطیروروش های تقطیردرآزمایشگاه شیمی :
تقطیر،معمولترین روش است که برای تخلیص مایعات به کار می رود.دراین عمل مایع رابه کمک حرارت تبخیرمی کنندوبخارمربوطه رادرظرف جداگانه ای متراکم می کنندومحصول تقطیررابدست می آورند.جنانچه ناخالصی های موجود درمایع اولیه فرارنباشند،درباقی مانده تقطیربه جامی مانندوتقطیر ساده جسم راخالص می نمایید.درصورتی که ناخالصی هافرارباشند،تقطیر جزءبه جزء مورد احتیاج خواهد بود.
مهمترین روشهای تقطیر:
1. تقطیرساده
2. تقطیرجزء به جزء
3. تقطیربابخار آب
4. تقطیردرفشارکم
استخراج :
استخراج روشی برای جداسازی بوده که مستلزم انتقال جسمی ازیک فازبه فازدیگرمی باشد.دربرخی مواقع لازم است برای بازیابی یک جسم آلی ازمحلول آبی ازراههایی غیرازتقطیراستفاده شود.یکی ازاین راهها تماس دادن محلول آبی بایک حلال غیر قابل امتزاج می باشد.اگرحلال خاصیت جداسازی راداشته باشدبیشترموادآلی ازلایه آلی به حلال آلی(حلال غیرقابل امتزاج)انتقال پیدا می کند. ازجمله خواص از حلال که دراستخراج اهمیت دارد قابلیت انحلال کم وفرار بودن رامی توان نام برد.دراستخراج دومحلول وجودداردابتدانمونه درحلال یک قرارداردکه ازحلال دوم برای استخراجآن استفاده می شود درنتیجه دارای ثابت تعادل بوده که به آن ثابت توزیع گویند.
تصعید :
در این روش از اختلاف فشار بخار اجسام جامد استفاده می شود و این عمل از جهتی به تقطیر ساده شباهت دارد. نمونه ناخالص در درجه حرارتی پایین تر از نقطه ذوب آن گرم میشود و مستقیما از حالت جامد به صورت بخار در می آید و بعد بخار حاصل فورا در سطح سردی به حالت جامد متراکم میشود (متبلور میشود). این دو مرحله بدون مداخله حالت مایع صورت میگیرد.
تبلور :
تبلور یکی از بهترین روش های تخلیص اجسام جامد است روش عمومی تبلور عبارت است از حل
کردن جسم در حلال مناسب به کمک گرما و تهیه محلول سیر شده جسم ، صاف کردن سریع محلول
گرم ، سرد کردن تدریجی محلول صاف شده به منظور راسب کردن به شکل بلور ، صاف کردن و
شستن بلورها با حلال سرد و خشک نمودن آن ها،و بالاخره تعیین نقطه ذوب بلور.
تبلور معمولا در موقع تبدیل یک حالت فیزیکی به حالت فیزیکی دیگر صورت میگیرد.
این تبدیل به سه صورت انجام می گیرد:
1.تبلور در هنگام تبدیل حالت مایع به جامد
2.تبلور در هنگام تبدیل حالت بخار به جامد سوبلیماسیون
3. تبلور مواد جامد
آزمایش شماره (1)
تعیین دمای ذوب نفتالین
به منظورتعیین دمای ذوب نفتالین ،مقداری ازنفتالین جامد رابه لوله مویین منتقل نموده ولوله را که یک انتهای آن بسته می باشد رادرحمام آب گرم قرارمی دهیم .درادامه یک دماسنج رادرداخل حمام قرارداده وزمانی که اولین ذرات حباب مانند خارج شده ازلوله مویین را مشاهده کرده دمارابااستفاده از دماسنج می خوانیم.سپس حرارت دادن نفتالین را ادامه می دهیم تازمانی که شدت خروج حباب ها به حداکثربرسدوخروج آنها پیوسته باشد. دراین لحظه مجددا دماراازدماسنج خوانده ویاداشت می نماییم.
بقیه ازمایش ها به زودی قرار داده میشود
عنوان آزمایش: تهیه اتیلن
(برای تهیه ی اتیلن روش کارهای مختلفی را می توان در کتابهای شیمی و اینترنت پیدا کرد.اما با وجود یکسان بودن اصل روش،گاهاً دستور کار چندان ساده و ملموس نیست.در این مطلب سعی می کنم ساده ترین روش تهیه اتیلن را که در هر آزمایشگاه شیمی و با ساده ترین امکانات قابل انجام است،بنویسم.)
هدف: تهیه ی اتیلن به روش آزمایشگاهی از اتانول و شناسایی آن با محلول پتاسیم پرمنگنات
مقدمه:
اتیلن ساده ترین آلکن با فرمول C2H4 است.که گازی است بی رنگ و بسیار آتش گیر.
برای تهیه اتیلن روش های مختلفی وجود دارد که از جمله می توان کراکینگ گرمایی اتان(1) و آبگیری از الکل(اتانول) (2)را نام برد.که روش اول صنعتی و روش دوم بیشتر جنبه ی آزمایشگاهی دارد.
(1) CH3-CH3 => CH2=CH2 + H2
(2) CH3-CH2-OH => CH2=CH2 + H2O
اتیلن ( و سایر آلکن ها) با پتاسیم پرمنگنات اکسید می شوند و به این ترتیب رنگ ارغوانی آن را تغییر می دهند.همچنین با آب برم نیز واکنش داده و رنگ قرمز قهوه ای آن را از بین می برند.(روش های شناسایی آلکن ها)
(C2H4 + 2KMnO4+4H2O= 3 C2H4(OH)2 + 2KOH + 2MnO2(s
MnO2 منگنز دی اکسید (قهوه ای رنگ)
KMnO4 پتاسیم پرمنگنات (ارغوانی)
پس تغییر رنگ در طی شناسایی از ارغوانی به قهوه ای خواهد بود.
در صورت استفاده از آب برم تغییر رنگ از قهوه ای یا زرد آب برم به بی رنگ خواهد بود.
C2H4+Br2= C2H4Br2
Br2: برم( قهوه ای یا زرد رنگ)
C2H4Br2 : دی برمو اتیلن (بی رنگ)
در انتها می توان گاز خروجی از لوله ازمایش را با احتیاط آتش زد،که در این صورت گاز اتیلن شعله ور می شود.
از اتیلن در صنعت برای تهیه پلاستیک پلی اتیلن بسیار استفاده می شود.همچنین اتیلن نوعی هورمون گیاهی است که در کشاورزی برای رسیدن میوه هایی که بصورت نارس چیده می شوند(مثل موز) استفاده می شود.
روش کار:
یک تکه پنبه کوچک را به کمک همزن شیشه ای یا یک پیپت در ته یک لوله آزمایش بزرگ قرار می دهیم.چند سی سی اتانول را توسط پیپت روی پنبه ای که ته لوله آزمایش گذاشته ایم،میریزیم،به طوری که کاملاً آغشته به الکل شود.(این آغشته شدن به الکل باید در حدی باشد که موقع افقی کردن لوله آزمایش الکل از پنبه نریزد.) سپس لوله آزمایش را به صورت افقی به میله و پایه ی فلزی وصل می کنیم.به کمک اسپاتول مقداری پودر آلومینیوم اکسید(آلومین) را در وسط لوله آزمایش قرار می دهیم.در لوله آزمایش را با یک درپوش سوراخ دار بسته و لوله ی شیشه ای خمیده ای را به آن وصل می کنیم.(مطابق شکل).
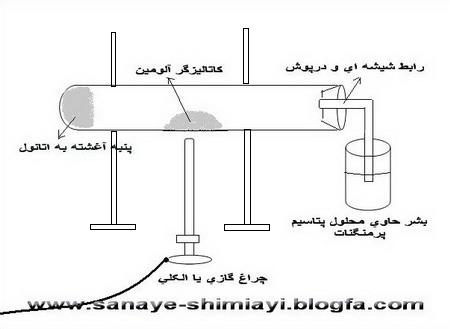
در یک بشر کوچک 50 سی سی تا نصف بشر محلول رقیق پتاسیم پرمنگنات( حدود 0.3% ) می ریزیم.و آن را زیر لوله رابط متصل به لوله آزمایش قرار می دهیم.حرارت را(در زیر قسمتی که آلومین قرار داده ایم) آغاز می کنیم.(گاهی نیز شعله را به سمت ته لوله آزمایش(جایی که پنبه را قرار داده ایم می بریم).اتانول در اثر حرارت و به کمک کاتالیزگر،آب زدایی شده و اتیلن تولید می کند.خروج گاز از لوله ی آزمایش با ایجاد حباب در محلول داخل بشر ثابت می شود.بخشی از این گاز بخار آب است و بخشی از آن گاز اتیلن.
با ورود اتیلن به داخل محلول پتاسیم پرمنگنات رنگ آن قهوه ای یا بی رنگ می شود.( بسته به اینکه محیط اسیدی باشد یا نه).
درست به همین روش می توان به جای پتاسیم پرمنگنات از آب برم نیز برای شناسایی اتیلن استفاده کرد.(بهتر است به جای برم از همن محلول پتاسی پرمنگنات برای ناسایی استفاده کرد چون برم سمی است و باعث سوختگی شدید پوست می شود)
در پایان گزارشکار باید نتیجه ی آزمایش و منابع احتمالی خطا را ذکر کرده و با توجه به مطالب گفته شده در مقدمه و متن روش کار،می توان به سوالات مربوطه پاسخ داد.
+نوشته شده در پنجشنبه 29 بهمن1388ساعت19:56توسط س | 3 نظر
زندگینامه ی مندلیف

دیمتری ایوانویچ مندلیف شیمیدان بزرگ روسی در فوریه 1834 در شهر «توبوسک» در سیبری روسیه متولد شد او چهاردهمین فرزند خانواده بود پدرش مدیر مدرسه بود او پدر خود را در کودکی از دست داد. او در مدرسه توپولسک استعداد درخشان خود را در ریاضی و فیزیک نشان داد و عصرها بعد مدرسه در کارگاه شیشه گری به مادرش کمک می کرد مدتی بعد کارگاه شیشه گری آتش گرفت و همه سرمایه شان از دست رفت. دیمیتری برای یافتن شغل بهتر به سن پترزبورگ رفت و در آن جا به تدریس پرداخت در سال 1850 توانست بورس تحصیلی بگیرد و به تحصیل در رشته ریاضی، فیزیک و شیمی بپردازد. او خانواده خود را هم به سن پترزبورگ برد اما متاسفانه مادر و خواهرش به بیماری سل دچار شدند و جان خود را از دست دادند و او تنها شد فقر از یک سو و اندوه از سوی دیگر او را چنان بیمار ساخت که پزشکان تصور کردند او نیز به سل میتلا شده است و به او توصیه نمودند برای معالجه و استراحت به یک محل خوش آب و هوا مسافرت نماید. دیمیتری به جزایر کریمه رفت و مدتی را در آنجا ماند. پس از مدتی او سلامت روحی خود را بازیافت و به سنت پترزبورگ بازگشت...
عنوان آزمایش: خالص سازی مواد به روش استخراج
هدف: استخراج آدیپیک اسید از فاز آبی به فاز آلی(اتر)
تئوری آزمایش:
استخراج روشی است برای جداسازی که در آن جسمی از یک فاز به فاز دیگر منتقل می شود. در بعضی مواقع لازم است برای بازیابی یک ماده آلی از راههایی غیر از تقطیر استفاده شود. یکی از این راهها تماس دادن محلول آبی با یک حلال غیر قابل اختلاط با آب است. اگر حلال مناسب باشد، بیشتر مواد آلی(در اینجا آدیپیک اسید) از لایه آبی به حلال آلی (که با آب امتزاج ناپذیر است) انتقال پیدا میکند.
از نظر کمی پخش یک جسم بین دو حلال غیر قابل امتزاج را بر حسب ضریب پخش K بیان میکنند. به عبارت دیگر ضریب پخش(k) یعنی: نسبت غلظت ماده ی حل شده در حلال اول، به غلظت همان ماده در حلال دوم.
حلالی که برای استخراج انتخاب می شود باید دارای این ویژگیها باشد:
1- با حلالی که دارای ماده مورد نظر است،مخلوط نشود.(سیستم دو فازی تشکیل دهد)
2- K ماده در حلال انتخاب شده بزرگ باشد. (یعنی ماده در حلال دوم بیشتر از حلال اول محلول باشد)
3- حلال نباید ما ماده مورد نظر واکنش دهد.
4- حلال انتخاب شده به آسانی تبخیر شود.
5- حلال نباید ناخالصی ها را استخراج کند.
در استخراج مایع-مایع از قیف جدا کننده (دکانتور) استفاده می شود.قیف نباید بیشتر از سه چهارم حجم آن پر شود چون در این صورت امکان هم زدن محلول وجود نخواهد داشت.هدف از تکان دادن و هم زدن این است که سطح تماس دو حلال افزایش یابد و ماده حل شده در حلال اول در مدت زمان کمتری بتواند به حلال دوم برود.(در آن حل شود).هر چند ثانیه یک بار باید قیف را برگرداند(شیر به سمت بالا) و آن را به آرامی باز کرد تا گاز قیف خارج شود.این عمل همیشه باید انجام شود ولی در دو حالت اهمیت بیشتری دارد:
1- وقتی که حلال مورد استفاده دمای جوش پایینی داشته باشد.
2- یک محلول اسیدی با محلولی از سدیم بیکربنات استخراج شود.(در این حالت گاز کربن دی اکسید آزاد می شود)
NaHCO3 + HA = NaA + H2O + CO2
پس از تکان دادن قیف و خارج کردن گازهای آن، قیف جدا کننده را روی گیره ی حلقه ای قرار می دهند و فرصت می دهند تا فازها به خوبی از هم جدا شوند.
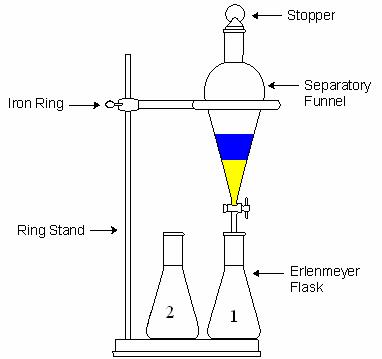
لایه ها طوری جدا می شوند که حلال سنگین تر در پایین قرار می گیرد اما گاهی ممکن است به دلیل حل شدن بیشتر ماده در فاز آلی، حلال آلی پایین تر از آبی قرار بگیرد.برای اطمینان از اینکه کدام فاز آلی و کدام آبی است،در یک بشر کوچک مقداری آب ریخته و سپس با باز کردن شیر قیف جدا کننده چند میلی لیتر از حلال پایینی را به بشری که در آن آب ریخته ایم اضافه می کنیم،اگر دو محلول در یکدیگر حل شوند فاز پایینی آبی است و در غیر اینصورت آلی است.
وسایل و مواد لازم:
آدیپیک اسید، سدیم هیدروکسید، محلول فنل فتالئین، دی اتیل اتر، آب مقطر
قیف جدا کننده، بورت، بشر، همزن، قطره چکان، ارلن،
روش کار:
حلال اول در این ازمایش آب و حلال دوم اتر است.ماده مورد نظر هم آدیپیک اسید می باشد.در این ازمایش میخواهیم آدیپیک اسید را که در آب محلول است،توسط اتر استخراج و به فاز آلی ببریم.
1 گرم آدیپیک اسید را در 100 سی سی آب مقطر حل می کنیم.(همان محلول 1% ).
(از این قسمت می توان غلظت آدیپیک اسید را در فاز آبی حساب کرد.به این صورت که با توجه به وزن آدیپیک اسید و جرم مولکولی آن تعداد مول را حساب کرده و تقسیم بر حجم محلول کنیم.
m/Mw=1/146=0.0068mol. =تعداد مول
M=mol/lit = 0.0068/ 0.01 = 0.68Mمولاریته
علاوه بر این می توان بصورت عملی نیز غلظت را در موارد مجهول با استفاده از تیتراسیون با یک محلول باز حساب کرد.)
25 سی سی از این محلول را در قیف جدا کننده می ریزیم و به آن 30 سی سی اتر اضافه می کنیم.عمل استخراج را با توجه به نکات عملی گفته شده انجام می دهیم و سپس مدتی قیف را روی حلقه ساکن می گذاریم تا دو فاز از هم جدا شوند.و هر فاز را بصورت جداگانه داخل ارلن می ریزیم.
در این حالت و پس از انجام عمل استخراج،آدیپیک اسید که در فاز آبی بود به فاز اتری(آلی) منتقل می شود.اما برای اینکه بدانیم چه مقدار از آدیپیک اسید به فاز آلی منتقل شده است، محلول اتری به دست آمده از عمل استخراج را،با محلول سدیم هیدروکسید تیتر می کنیم.
M1V1= M2V2
M1 مولاریته اسید در فاز آلی
V1 حجم فاز آلی
M2 مولاریته محلول سدیم هیدروکسید ( این محلول را خودمان تهیه می کنیم پس مقدار مولاریته ی آن را می توانیم با توجه به جرمی از سود که در مقدار مشخصی آب حل کرده ایم حساب کنیم)
V2 حجم محلول سدیم هیدروکسید مصرف شده (در تیتراسیون)
(چون آدیپیک اسید یک اسید دو عاملی است حتماً باید موقع محاسبه غلظت بعد از انجام تیتراسیون ضریب دو را نیز در فرمول فوق واردکنیم.)
به این ترتیب می توان مولاریته اسید در فاز آلی یعنی M1 را بدست آورد.و به این ترتیب متوجه می شویم که چه مقدار از اسید از فاز آبی به فاز آلی منتقل شده است.و در این حالت K به آسانی قابل محاسبه خواهد بود.
مثلاً اگر مولاریته با انجام تیتراسیون 0.5 مولار بدست اید.در این حالت K به این صورت خواهد بود:
0.18 = 0.5 - 0.68 = غلظت اسید باقی مانده در فاز آبی
0.5= غلظت اسید در فاز آلی
K= 0.5/0.18= 2.77
مفهوم این عدد این است که ماده مورد نظر در حلال دوم(اتر) 2.77 برابر حلال اول(آب) حل می شود.
در پایان می توان به این سوالات پاسخ داد:
1- وزن اسید در لایه ی اتری و آبی چقدر است؟
راهنمایی: مولاریته اسید در هر دو فاز را بدست آوردیم.برای به دست آوردن وزن اسید در هر لایه کافیست به حجم برداشته شده از دو حلال دقت کنیم. یعنی با داشتن مولاریته و حجم به راحتی تعداد مول را بدست آورده و تعدا مول را با استفاده از جرم مولکولی اسید،به وزن(جرم) تبدیل کنیم.
2- درصد اسید در لایه ی اتری و آبی چقدر است؟
راهنمایی: پس از بدست اوردن جواب سوال اول، می توان درصد وزنی وزنی را نیز حساب کرد. مثلا اگر وزن ترکیب در 25 سی سی 2 گرم باشد،بدیهی است که در صد سی سی 8 خواهد بود(8درصد)
3- بازده استخراج چقدر است؟
راهنمایی: در حالت ایده آل (یعنی بازده 100%) باید کل اسید از فاز آبی به آلی منتقل شود که مطمئناً این گونه نیست.و مقداری از اسید در آب باقی خواهد ماند.بازده را در اینجا می توان برحسب غلظت یا وزن حساب کرد.(که جوابها یکی است)
بازده= مقدار استخراج شده ی اسید تقسیم بر مقدار اولیه اسید
4- غلظت کل اسید داده شده در مجهول اولیه چقدر بوده است؟
غلظت اولیه اسید در بالا در متن روش کار حساب شد. و یا می توانستیم از طریق تیتراسیون محاسبه کنیم.
5- K را محاسبه کنید.
مقدار فرضی k در بالا حساب شد. به همان روش می توان مقدار k را در آزمایش حساب کرد.
در پایان آزمایش باید نتیجه گیری و منابع خطا ذکر شود.
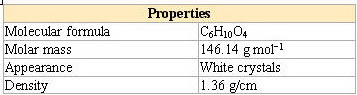
* جدول خصوصیات آدیپیک اسید جهت اطلاع بیشتر:
در فیزیولوژی به بررسی کارکرد اندامهای مختلف بدن مثلاً وظیفه قلب در بدن، وظیفه مخچه در بدن، وظیفه کلیه در بدن و غیره پرداخته میشود.
مقدمه
فیزیولوژی یکی از مهمترین شاخههای بیولوژی است که به مطالعه اعمال حیاتی موجود زنده ، اندامها ، بافتها ، سلولها و عناصر سلول میپردازد. برای درک عمیق اعمال حیاتی ، سعی میگردد که خواص و روابط بین این اعمال و تغییراتشان در محیطهای مختلف و یا در شرایط گوناگون موجود زنده مورد بررسی قرار گیرد. فیزیولوژی ، تکامل و توسعه این اعمال در یک گونه و در یک موجود زنده و همچنین تغییرات و تطابق آنها با شرایط محیطی متغیر را مورد مطالعه قرار میدهد.
طبقه بندی فیزیولوژی
فیزیولوژی عمومی :
فیزیولوژی عمومی قوانین حاکم بر پاسخ ماده زنده نسبت به تاثیرات محیطی و فرایندهای حیاتی موروثی ، همچنین پدیدههایی که موجود زنده را از غیر زنده متمایز میسازد، را مورد مطالعه قرار میدهد. از شاخههای فیزیولوژی عمومی میتوان فیزیولوژی سلولی را نام برد.
فیزیولوژی مقایسهای :
فیزیولوژی مقایسهای ویژگی خاص یک عمل را در گونههای مختلف و در یک گونه در مراحل مختلف تکامل فردی مورد بررسی قرار میدهد. هدف نهایی فیزیولوژی مقایسهای که اکنون به فیزیولوژی تکاملی تغییر نام یافته است، مطالعه قوانین تکامل عملکردهای فردی و گونهای است. به غیر از فیزیولوژی عمومی و تکاملی شاخههای دیگری مثل فیزیولوژی ردههای جانوری یا گروههای جانوری (نظیر جانوران مزرعه ، پرندگان ، حشرات) و یا فیزیولوژی گونههای خاص (نظیر گوسفند و گاوها) و یا فیزیولوژی اندامهای داخلی (مثل کبد ، کلیه ، قلب) و فیزیولوژی بافتها (مثل بافت عصبی و عضلانی) وجود دارد.
فیزیولوژی تخصصی :
به شاخههایی از فیزیولوژی که به مطالعه عملکرد خاصی میپردازند (مثل فیزیولوژی گوارش یا گردش خون) و اغلب به عنوان رشته مشخصی از علوم نیز شناخته میشوند، فیزیولوژی تخصصی میگویند. به تعداد گروههای مختلف موجودات زنده ، اندامها ، بافتهای مختلف و فعالیتهای گوناگون حیاتی ، فیزیولوژی تخصصی وجود دارد. فیزیولوژی انسان و جانوران عالیتر نیز از شاخههای فیزیولوژی تخصصی است که زیاد مورد مطالعه قرار گرفته است.
فیزیولوژی انسانی به شاخههایی مانند فیزیولوژی کار ، فیزیولوژی تمرینات بدنی و ورزش ، فیزیولوژی تغذیه و ... تقسیم میشود.
فیزیولوژی پاتولوژیکی :
شاخهای تخصصی از فیزیولوژیست است که با مسائل خاص خود از فیزیولوژی طبیعی که فرایندهای حیاتی را در فرد سالمی بررسی میکند، مشخص میشود. در این شاخه از فیزیولوژی قوانین حاکم بر علت توسعه و دوره فرایند (پاتولوژیک) در موجود زنده مورد مطالعه قرار میگیرد، یعنی به مطالعه پدیدههای اختصاصی که فعالیت حیاتی موجود بیمار را از فرد سالم مشخص میسازد، میپردازد.
روشهای تحقیق در فیزیولوژی
فیزیولوژی علمی تجربی است و فیزیولوژیست مشاهداتش را به صورت کمی و کیفی بیان میکند. فیزیولوژیست برای ثبت و اندازه گیری مشاهداتش از ابزارها و دستگاههای خیلی پیچیده استفاده میکند. این دستگاههای خیلی حساس و دقیق که توسط فیزیولوژیستهای مدرن بکار میروند، سبب بالا رفتن قدرت تفکیک اندامهای حسی میشوند. فیزیولوژزیستها فقط به مشاهده تنها اکتفا نمیکنند، بلکه تلاش میکنند علت و چگونگی وقوع فرایندهای فیزیولوژیک را کشف نمایند.
تجربیات فیزیولوژی به اشکال خیلی متفاوت انجام میگیرد. اعمال حیاتی را میتوان با تغییر عوامل محیطی ، یا با قطع کامل اندام یا پیوند اندام ، قطع عصب و رگ اندام ، فیستول گذاری و کاتترگذاری و استفاده از محرکهای گوناگون مورد مطالعه قرار داد. تجربیات فیزیولوژی به دو صورت تجربه آنی و تجربه زمانبر انجام میشود. این تجربیات بیشتر بر روی جانوران صورت میگیرند تا انسان. امروزه نتایج مهم و قابل توجهی توسط کامپیوترهای مدرن بدست آمده است.
فیزیولوژی و ارتباط آن با علوم دیگر
فیزیولوژی با علوم دیگر رابطه نزدیک دارد، مثل علم فیزیک ، شیمی. فیزیولوژی و علوم بافت شناسی (هیستولوژی) ، سلول شناسی (سیتولوژی) ، تشریح (آناتومی) و ریخت شناسی (مورفولوژی) کاملا به هم وابستهاند، به هم دیگر کمک کرده و بر هم تاثیر متقابل دارند، زیرا اعمال حیاتی بدون شناخت ساختمان ممکن نیست. از طرفی نقش اعمال حیاتی بر شکلگیری ساختار بدن انکارناپذیر است. فیزیولوژی و پزشکی نیز متقابلا در پیشرفت هم موثر بودهاند. پیشرفت علم سیبرنیتیک و اختراع کامپیوترهای مدرن نیز در پیشرفت فیزیولوژی تاثیر بسزایی داشته است.
آناتومی علم تشریح ساختار بدن است . آناتومی توصیف یا تشریح یک ساختار است، از راه جدا کردن تکههای مختلفی که بر هم سوار شده و آن ساختار را ساخته اند. واژه آناتومی (Anatomy) از ترکیب پیشوند ana به معنای up (به مفهوم بر بالای هم سوار شده و ساخته شده و کالبد) و واژه یونانی tomy به معنای (بریدن و قطعه قطعه کردن) بدست آمده است و همان مفهوم از هم جدا کردن، اجزای یک کالبد را میدهد. آناتومی (کالبد شناسی) انسان (Human anantomy) عبارتست از “مطالعه ساختارهایی که تن (کالبد) انسان را تشکیل میدهند”.

tarife anatomy1 تعریف واژه آناتومی چیست
در بیان آناتومی گفته میشود که مطالعه ساختار بدن انسان است. البته بیشتر آناتومیست ها این را قبول ندارند، چرا که آنان بیان میکنند این تعریف بدون در نظر گرفتن اعمال مربوط به قسمت های مختلف بدن است. بنابراین معنی دقیق آناتومی عبارتست از مطالعه ساختار بدن و ارتباط آن با اعمال قسمت های مختلف آن ساختار.
در بررسی آناتومی، چنانچه بررسی با چشم غیر مسلح صورت گیرد آن را کالبد شناسی درشت بین (Macroanatomy) گویند و اگر با کمک میکروسکوپ انجام گیرد، آن را کالبد شناسی ریزبین (Microanatomy) یا بافت شناسی (Histology) گویند. شناسایی بدن انسان در دوره جنینی، جنین شناسی یا رویان شناسی (Embryology) نامیده می شود. ولی واژه آناتومی یا کالبد شناسی، در زبان فارسی بیشتر بیان کننده همان ماکروآناتومی است.باز بینی و بررسی مجدد که روی جسد انجام میگیرد، کالبد شکافی یا تشریح خوانده میشود.
از آنجا که فیزیک بخشی از علم و دانش است بنابراین لازم است برای درک فیزیک، شناختی از علم داشته باشیم.
علم فرآیند کاویدن و به کارگیری دانش دنیای اطرافمان است.
اگر پیگیری و جستجوی دانش به خاطر خود آن باشد ما آن را تحت عنوان "علوم محض" یا "علوم پایه" طبقهبندی میکنیم. توسعه و بسط روشهای استفاده از دانش، "علوم کاربردی" را تشکیل میدهند. به عنوان مثال، اختر شناسی عمدتاً جزو علوم محض است ولی رشتههای مهندسی "علوم کاربردی" هستند. مطالبی که در آینده مطالعه میکنیم ترکیبی از مفاهیم پایهای (که باور داریم یادگیری آن به خودی خود مهم است) و مثالهایی از روشهای مختلفی که این مفاهیم در زندگی روزمره ما کاربرد دارند، است.
در کنار علوم محض و کاربردی، روشهای دیگری برای طبقهبندی حیطههای مختلف علم وجود دارد. علوم فیزیکی (فیزیک و زمینشناسی دو مثال آن هستند)، علوم زیستی (زیستشناسی و پزشکی) و علوم اجتماعی (روانشناسی و جامعهشناسی) نیز حیطههای مختلف علوم هستند. همانند بسیاری از طبقه بندیهایی از این نوع، این حیطهها همپوشانی دارند. مثلاً بیوفیزیک نمونهی خوبی از همپوشانی فیزیک و زیستشناسی است.
تعریف فیزیک به سادگی برخی حیطههای علم مثل زیستشناسی (مطالعهی موجودات زنده) نیست. اگر از چندین فیزیکدان بخواهید که این کلمه را تعریف کنند، به احتمال زیاد دو پاسخ یکسان را پیدا نمیکنید. یک تعریف خوب و مناسب از فیزیک میتواند این باشد:
فیزیک راهی برای مدل کردن قوانین حاکم بر طبیعت و پیش بینی کردن پدیدههای جدید است.
در آینده مطالب بیشتری در مورد ساختارهای ماده (مثل اتم و هسته)، چگونگی بر هم کنش ماده توسط گرانش، الکتریسیته، مغناطیس.... میآموزیم. در خود فیزیک، تقسیم بندیهای گستردهای وجود دارد. جدول زیر برخی حیطههای متداول که در آن فعالیتهای تحقیقاتی امروزه صورت میگیرد آورده شده است.
برخی تقسیم بندیهای متداول فیزیک معاصر، تقریبا به ترتیب تعداد دکترهایی که هر سال در آن تحصیل میکنند.
حیطه
سرفصلهای تحقیق
مادهی چگال
ساختارها و خواص جامدات و مایعات
اختر فیزیک
ستاره، کهکشان، سیر تکامل هستی
ذرات و میدان
ذرات و میدانهای بنیادی، شتابدهندههای پر انرژی
نورشناسی و فوتونیک
نور و دانش فنی لیزر
اتمی و مولکولی
اتم و مولکول
فیزیک هستهای
هسته، مواد هسته، کوارکها و گلونها
فیزیک پلاسما و گداز
پلاسما، پژوهشهای گداز و همجوشی
علم مواد
کاربردهای فیزیک ماده چگال
بیوفیزیک
فیزیک پدیدههای زیستی
فیزیک جو و فضا
هواشناسی، خورشید، سیارات
همپوشانی بسیاری بین این تقسیمبندیها وجود دارد و برخی از آنها به وضوح متمایل به سمت سایر علوم مثل زیستشناسی و شیمی است.
وقتی مبانی و مفاهیم اولیه به نوآموز آموخته میشود حیطهی دانش فیزیک به شکلهای مختلف تقسیمبندی میشود. سرفصلهایی که به دانشآموزان در اولین مواجهشان با فیزیک ارائه میشود معمولاً مطابق رشد و گسترش تاریخی آنها است (ابتدا حرکت و فیزیک کلاسیک، فیزیک نسبیت و کوانتوم، ذرات بنیادی و در پایان اخترشناسی).
در واقع ترتیب یادگیری فیزیک تقریباً شبیه همان مراحلی است که ما در زندگی روزمره با آن مواجه ایم و آن را تجربه میکنیم. به عنوان مثال ما مردمی را میبینیم که در حال حرکتند و چیزهایی که برخورد میکنند، برای همین این مطالب را زودتر یاد می گیریم. اما عدهی بسیار کمی از مردمایدهای از کوارکها و ذرات بنیادی دارند و در زندگی روزمره با آنها مواجه نیستیم. با این حال همهی ما و تمامی موادی که با آنها سرو کار داریم عمدتاً از کوارک ساخته شدهاند!

اکثر دانشآموزانی که درس مقدماتی فیزیک را میگیرند در فیزیک متخصص نمیشوند. اغلب آنهایی که فیزیک تحصیل کردهاند در تجارت، صنعت، کارهای دولتی یا آموزشگاهها مشغول کار هستند. بنابر آمار ارائه شده در سال 1990، اغلب کارشناسها و کارشناسهای ارشد رشتهی فیزیک در دو مورد اول و دکترهای فیزیک در دو مورد آخر مشغول به کار هستند. علاوه بر حرفه و شغلهای متعارف مثل پژوهشگر و معلم، افراد فارغ التحصیل فیزیک در کارهای مهندسی، مدیریت، دانش رایانه و دانش فنی نیز مشغول به کارند.
اغلب فیزیکدانها نه به خاطر محفوظات و دانستههای فیزیکیشان بلکه به خاطر تجربیاتشان در "حل مسئله" و "دانش فنی پیشرفته" به کار گرفته میشوند.
شیمی چیست؟
انسان از دیرباز علاقهی فراوانی در مطالعهی اجزاء تشکیل دهندهی ماده داشته است. شیمی شاخه ای از علوم تجربی است که بر ماده، اجزاء ماده و به وجود آمدن ماده جدید و تغییرات آن و مسائل پیرامون این را بررسی می کند. در گذشته انسان سعی داشت که با عملیاتی مناسب مس را به طلا تبدیل کند اما هرگز موفق نشد و دلیل این امر در شیمی نهفته است.
همواره تلاش انسان برای بیان ماهیت مواد و طریقهی دگرگونی آنها ناموفق بوده است. همچنین کیمیاگری نیز در این مورد ناتوان بوده است. به هرحال کیمیاگری به کمک انجام تحقیقات اولیه و ثبت نتیجهها، پایهگذار شیمی مدرن عمیقی پیدا کرد.
دانش شیمی علم مطالعه و بررسی اتمهای مواد، پیوندها و مولکولهای آن هاست. شیمی میتواند خواص ماده، چگونگی تغییرات و شیوهی تولید آنها را از کوچک ترین جزء ماده یعنی همان هسته اتم گرفته و تا کهکشانها بررسی کند. علم شیمی از اجسام و خواص و ساختمان آن ها و واکنش هایی که آن ها را به اجسام دیگر تبدیل می نماید بحث می کند. متخصصان علم شیمی با مطالعه و تحقیق و آزمایش، به ابداع و نوآوری پرداخته و یا فرآوردههای شیمیایی را کنترل میکنند.
تاریخچهی شیمی
در حقیقت نظریهی اتمی بنیان علم شیمی را بنا نهاده است. در این نظریه تمام مواد از واحدهای بسیار کوچکی به نام اتم تشکیل شدهاند. اصل بقای جرم یکی از اصول و قوانینی است که شیمی را به عنوان یک علم تأثیرگذار مطرح کرده است. این قانون بیان میکند که در طول انجام یک واکنش شیمیایی معمولی، مقدار ماده تغییر نمیکند. ( امروزه فیزیک مدرن ثابت کرده که در واقع این انرژی است که بدون تغییر میماند و همچنین انرژی و جرم با یکدیگر رابطه دارند ).
شیمی چیست؟
این مطلب به طور ساده به این معنی است که اگر ده هزار اتم داشته باشیم و مقدار زیادی واکنش شیمیایی انجام پذیرد، در پایان ما همچنان به طور دقیق ده هزار اتم خواهیم داشت. اگر انرژی از دست رفته یا به دستآمده را مد نظر قرار دهیم، مقدار جرم نیز تغییر نمیکند. شیمی کنش و واکنش میان اتمها را به تنهایی یا در بیشتر موارد به همراه دیگر اتمها و بهصورت یون یا مولکول(ترکیب) بررسی میکند. واژه شیمی خود داستان درازی دارد.
ریشه این نام در واژه کیمیاست. خاستگاه واژه کیمیا از زبان فارسی باستان است و در گذشته فرقی بین شیمی و کیمیاگری قائل نبودند. این امر تا زمانی بود که که رابرت بویل در سال 1661 در کتاب شیمیدان شکاک میان شیمی و کیمیا تفاوت قائل شد. پس از آن شیمی با ارائه قانون پایستگی جرم، به یک دانش تکاملیافته تبدیل شد. دغدغهی هر دو دانش کیمیا و شیمی شناخت طبیعت مواد و چگونگی دگرگونی آنها بود، اما تنها شیمی ازشیوههای علمی قوی بهرهمند شد.
اولین واکنش شیمیایی که انسان توانست آن را کنترل و مهار کند، واکنش سوختن و آتش بود. در آن زمان آتش حکم یک نیروی عرفانی را داشت که مادهای را به یک ماده دیگر تبدیل می کرد در حالی که همراه با نور و گرما نیز بود. ذوب فلزات، تهیهی آجر و کشف شیشه مواردی هستند که به آتش وابسته بودند. در ایران، مصر و یونان موارد سفالگریهای با ارزش حاصل از ترکیب سیلیس و مواد مختلف دیده شده است.
در یونان باستان فیلسوفان تلاش میکردند تا بدانند چرا مواد مختلف خاصیتهای متفاوت (رنگ، بو و غلظت) و حالتهای متفاوت (جامد، مایع و گاز) دارند و با شیوههای متفاوت با یکدیگر واکنش میدهند. در آن زمان ارسطو از(عناصر چهارگانه) سخن گفت و اعتقاد داشت که جهان از چهار عنصر آب، هوا، خاک و آتش ساختهشدهاست. از این جهت یونانیان قرن پنجم که همواره در صدد پی بردن به رموز و اسرار طبیعت بودند آب را که مایه حیات سایر موجودات است، عنصری ساده می پنداشتند حال آنکه آب ترکیبی از دو عنصر ساده اکسیژن و هیدروژن است.
کیمیا گری و شیمی
از دیرباز انسان ها بسیار مشتاق بودند که بتوانند فلزهایی ارزان و کم ارزش را به فلزی گران بها همچون طلا تبدیل کنند. به اعتقاد آنان سنگ فلاسفه مادهای بود که میتوانست چنین کاری را انجام دهد. این موضوع سبب شد که علمی به نام کیمیا پدید آید. در کیمیا تنها بحث تبدیل فلزهای ارزان به فلزهای گران بها نبود. آن زمان این امید وجود داشت که کیمیا بتواند کمکی کند تا دارویی ساختهشود که منجر به بهبودی مردم شود.
شیمی چیست؟
مردم امیدوار بودند که کیمیاگران بتوانند مادهای به نام آب حیات یا اکسیر زندگیبه وجود بیاورند تا به کمک آن مرگ انسانها را به تأخیر بیندازند اما هرگز سنگ جادو و آب حیات به وجود نیامد. در قرن هشتم میلادی جابر بن حیان که از شاگردان امام ششم شیعیان بود تحولی در علم شیمی به وجود آورد و توانست اسیدها و بازها را تفکیک کند و او را پدر علم شیمی نامیدهاند. دانشمندان دیگر نیز همچون ابن سینا نظریههای کیمیا از جمله داستان سنگ فلاسفه را رد کردند.
شیمی و زندگی
شیمی علمی است که 115 عنصر طبیعت را همراه نام خود دارد و بدون عناصر حیات مفهومی نخواهد داشت. شیمی همواره در زندگی انسان دخالت کامل داشته و به اندازهای که تمدن کنونی بیشتر شود دخالت آن در قسمتهای مختلف زندگی نیز زیادتر خواهد شد. ما در دنیایی زندگی می کنیم که پر از مواد شیمیایی گوناگون است.
بعضی از این مواد مانند آب کاملاً برایمان آشنا است اما بسیاری مواد دیگر وجود دارند که چندان آشنا نیستند. به عنوان مثال چرخهی آب در طبیعت یک فعالیت کاملا شیمیایی است. واقعیت آن است که ما از هر لحاظ با مواد شیمیایی روبرو هستیم. لباسی که می پوشیم، غذایی که مصرف می کنیم، کاغذی که مطالب را روی آن می خوانیم همگی مواد شیمیایی به شمار می روند.
دانش شیمی به عنوان یکی از علوم پایه، زیربنای علوم مختلفی همچون بیولوژی، بیوتکنولوژی، پزشکی، دندان پزشکی، داروسازی و رشتههای متعدد مهندسی است. دیگر کاربرد آن صنایع شیمیایی است. صنایع شیمیایی عبارت است از صنایعی که در آن ها واکنش شیمیایی انجام میگیرد یعنی اقسام مواد اولیه تبدیل به محصولات جدید میگردد که خواص این محصولات تا حدودی با مواد اولیه متفاوت است.
شیمی با سایر علوم چگونه ارتباط دارد؟
شیمی از یک سو با زیست شناسی، فیزیک و زمین شناسی و از سوی دیگر با سایر حوزه های مختلف مانند پزشکی، دارو یا صنایع گوناگون همچون نفت، پتروشیمی، صنایع معدنی و شیمیایی ارتباط تنگاتنگی دارد، به همین دلیل در اغلب رشته های تحصیلی صنایع مختلف، گرایش علم شیمی وجود دارد.
علاوه بر این ها می تواند در صنایع پزشکی و دارویی نیز کاربرد داشته باشد، به عنوان مثال امروزه از آلیاژها و ترکیبات شیمیایی در دندانپزشکی برای پر کردن دندان استفاده می شود. در فرآوری مواد معدنی شیمی مهم ترین نقش را ایفا می کند تا بتوانیم فلز مورد نظر را از داخل کانیهای موجود در سنگ استخراج کنیم.
پرتوپزشکی شاخهای از پزشکی است که در آن تشعشع خواص هستهای نوکلیدهای رادیواکتیو و نوکلیدهای پایدار ، هم برای تشخیص و هم برای درمان امراض بکار میروند. این امر میتواند یا با پرتودهی مستقیم مریض با یک چشمه تشتعشع خارجی یا با تزریق داروهای نشاندار با رادیواکتیویته به مریض تحقق یابد . رشته پرتوپزشکی از نوع رشته های میان رشته ای و یا چندرشته ای به شمار می آید و ترکیبی از رشته های مهندسی هسته ای، رادیوبیولوژی، مهندسی برق، فیزیک پزشکی و پزشکی است.





 Bionuclear Instrument -1 :در این حوزه کلیه ابزارها و دستگاههای تشخیصی (تصویربرداری) و درمانی (پرتودرمانی) از لحاظ ساختار، فیزیک دستگاه و نحوه عملکرد مورد مطالعه و بررسی قرار می گیرند .
Bionuclear Instrument -1 :در این حوزه کلیه ابزارها و دستگاههای تشخیصی (تصویربرداری) و درمانی (پرتودرمانی) از لحاظ ساختار، فیزیک دستگاه و نحوه عملکرد مورد مطالعه و بررسی قرار می گیرند .